对于每一个开展 PCI的中心,应建立质量控制体系包括:
(1) 回顾分析整个中心及每个术者的介入治疗结局和质量;
(2) 引入风险调控措施;
(3) 对复杂病例进行同行评议;
(4) 随机抽取病例作回顾分析。
资质要求为每年完成的必血管疾病介入诊疗病例不少于 200 例,其中治疗性病例不少于100 例,主要操作者具备介入治疗资质且每年独立完成PCI>50 例,血管造影并发症发生率低于0.5%,心血管病介入诊疗技术相关病死率低于 0.5%。
风险-获益评估是对患者进行血运重建治疗决策的基础。运用危险评分可以预测心肌血运重 建手术病死率或术后主要不良心脑血管事件MACCE)发生率,指导医师对患者进行风险分层,从而为选择适宜的血运重建措施提供参考。常用的危险评分系统特点如下。
1. 欧洲心脏危险评估系统I(EuroSCORE II):
EuroSCOREI通过 18 项临床特点评估院内病死率。
2. SYNTAX 评分:
是根据 11 项冠状动脉造影病变解剖特点,定量评价病变的复杂程度的危险评分方法。对于病变既适于 PCI,又适于冠状动脉旁路移植术,且预期外科手术病死率低的患者,可用 SYNTAX 评分帮助制定治疗决策,至今仍在临床上广泛使用。
3. SYNTAXⅡ评分:
是在 SYNTAX 评分的基础上,新增是否存在无保护左主干病变,并联合6项临床因素(包括年龄、肌酐清除率、左心室功能、性别、是否合并慢性阻塞性肺疾病和周围血管病)的风险评估法,在预测左主干和复杂三支病变血运重建的远期死亡率方面,优于单纯的 SYNTAX 评分。
来自中国的研究显示,对于无保护左主干病变患者,SYNTAXII评分预测 PCI术后远期病死率的价值,优于 SYNTAX 评分。另一项中国的多中心研究显示,对无保护左主干病变患者,用整合了临床和冠状动脉解剖学因素的 NERSⅡ年分预测。主要不良心脏事件(MACE)发生 率,优于SYNTAX 评分,NERSHI评分>19 分是MACE 独立预测因素。

血运重建策略选择

SCAD血运重建方式选择应依据指南,不能开展,CABG 的医院,应将适宜患者转诊至有心脏外科手术能力的医院手术治疗。
非 ST 段抬高型急性冠状动脉综合征(NSTE-ACS)。
在无心电图ST段抬高的前提下,推荐用高敏肌钙蛋白检测作为早期诊断工具之一, 并在 60min 内获取检测结果,根据即刻和1hhs-cTn 水平快速诊断或排除 NSTEMI。
建议根据患者的病史、症状、体征、心电图和肌钙蛋白作为风险分层的工具。采用全球急性冠状动脉事件注册(global registry of acute coronary events,GRACE)预后评分进行缺血危险分层,分为紧急(2h以内)、早期(24h以内) 和延迟(72h以内) 3种血运重建策略(包括PCI和CABG)。
急性 ST 段抬高型心肌梗死(STEMI)
减少时间延误是 STEMI实施再灌注治疗的关键问题,应尽量缩短首次医疗接触(FMC)至PCI的时间和FMC至医院转出时间,从而降低院内死亡风险。对首诊可开展急诊 PCI的医院,要求 FMC 至 PCI时间<90 min。对首诊不能开展急诊PCl 的医院,当预计FMC至PCI的时间延迟<120min时,应尽可能将患者转运至有直接PCI条件的医院。
STEMI血运重建策略选择
如预计 FMC 至 PCI的时间延迟>120 min,对有适应证的患者,应于 30 min 内尽早启动溶栓治疗。近期FAST-MI注册研究、FAST-PCI研究、STREAM研究以及2项基于中国人群的研究均显示,溶栓后早期实施PCI的患者30d病死率与直接PCI的患者无差异,溶栓后早期常规PCI的患者1年MACCE发生率有优于直接PCI的趋势。因此,对 STEMI患者尽早溶栓并进行早期PCI治疗是可行的,尤其适用于无直接PCl 治疗条件的患者。溶栓后早期实施冠状动脉造影的时间宜在3~24h,其最佳时间窗尚需进一步研究。
对合并多支病变的STEMI患者,美国2013年及中国2015年STEMI指南均建议仅对梗死相关动脉(IRA)进行干预,除非合并心源性休克或梗死IRA行PCI后仍有持续性缺血征象,不应对非IRA行急诊PCI。
然而,最新荟萃分析均显示,对部分STEMI合并多支血管病变的患者行急诊PC或择期PCI时,干预非IRA可能有益且安全。美国2015年STEM指南更新中,建议对STEMI合并多支病变、血液动力学稳定患者,可考虑干预非IRA(可与直接PC同时或择期完成)。HORIZONS-AMI等研究提示,择期完成多支PCI的临床获益可能优于直接PCI同期干预非IRA。对于合并心源性休克和严重心力衰竭的STEMI患者,应由经验丰富的医师完成PCI。
PCI术中操作: 介入治疗入径
股动脉径路是PCI的经典径路。目前在我国大多选择经桡动脉径路(血管相关并发症少,患者痛苦少),应作为首选推荐(I,A)。
PCI术中操作: 支架选择
新一代DES采用了不同的支架框架材料(包括钴铬合金、铂铬合金等)、新的抗增生药物[包括依维莫司(evemlimus)和佐他莫司(zotamlimus以及生物可降解材料作涂层,其生物相容性更好,支架梁更薄,因而DES处管壁较早内皮化降低了新生内膜过度增生、再狭窄率及晚期和极晚期支架内血栓形成的发生率。
对以下情况推荐置入新一代DES: NSTE-ACS患者,STEMI直接PCI患者,冠心病合并糖尿病患者,冠心病合并慢性肾脏疾病(CKD)患者。
对以下冠状动脉病变推荐置入新一代DES: 开口处病变、静脉桥血管病变及支架内再狭窄病变。对左主干合并分叉病变和慢性闭塞病变,优先考虑应用新一代DES,以降低再狭窄率。
对3个月内计划接受择期非心脏外科手术的患者行PCI时,可考虑置入裸金属支架(BMS)或经皮冠状动脉腔内血管成形术(PTCA)(Ⅱa,B);
对高出血风险、不能耐受12个月DAPT,或因12个月内可能接受侵入性或外科手术必须中断DAPT的患者,建议置入BMS或行PTCA(I,B)
PCI术中操作: 药物洗脱球囊
推荐用药物洗脱球囊治疗BMS或DES支架内再狭窄病变(I,A)。
对BMS和DES相关的再狭窄病变、多层支架病变、大的分支病变及不能耐受DAPT的患者: 药物洗脱球囊可考虑作为优先选择的治疗方案
PCI术中操作:血栓抽吸装置
不推荐直接PCl前进行常规冠状动脉内手动血栓抽吸。在直接PCI时,对经过选择的患者(如血栓负荷较重、支架内血栓),可用手动或机械血栓抽吸,或将其作为应急使用(Ⅱb,C)。血栓抽吸时应注意技术方法的规范化,以发挥其对血栓性病变的治疗作用。

冠脉造影结果及病变分型

1、冠脉造影的入路
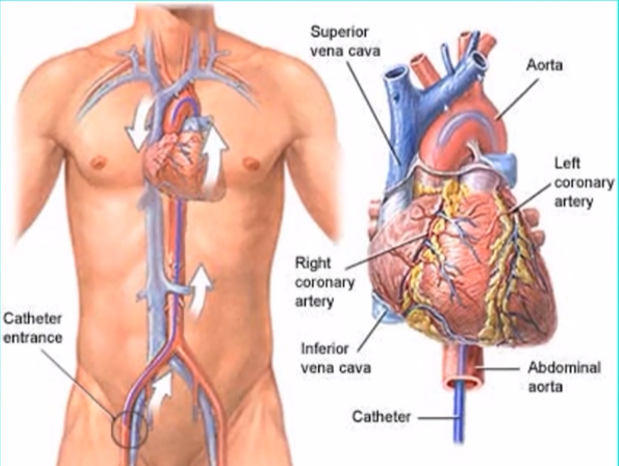
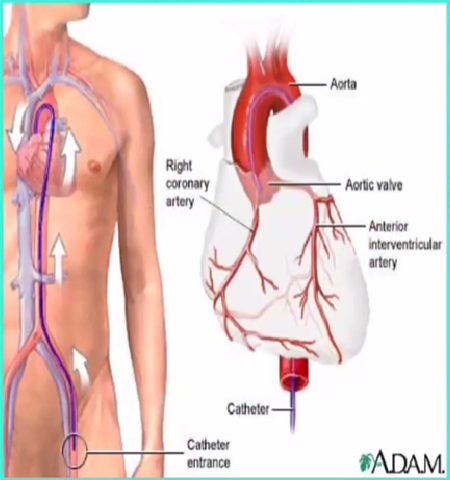
经股动脉法
经桡动脉法
经肱动脉法
2.冠脉斑块的形态学分类
局限性病变: 病变长度<10mm
管状病变: 病变长度10~20mm
弥漫性病变: 病变长度>20mm
偏心性病变: 病变斑块偏向管腔一侧
同心性病变:斑块以管腔中心均匀分布
成角性病变: 病变处血管成角>45度
狭窄性病变: 病变血管管腔狭窄但未闭塞
闭塞性病变: 病变血管无造影剂显影
不规则性病变: 轻度的管腔不光滑病变<25%
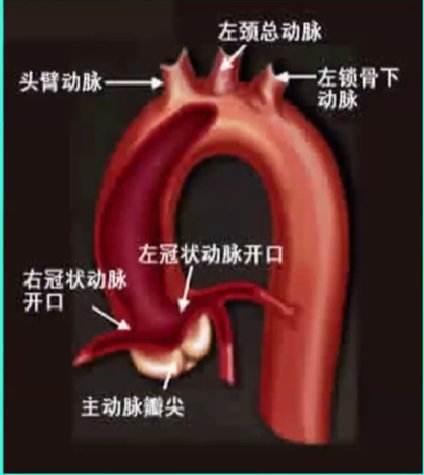
开口病变: 距冠状动脉开口3mm范围内的病变
分叉病变: 病变邻近较大分支开口或累及较大分支口部慢性完全闭塞性病变。
迂曲病变
I度(轻度)迂曲: 局部血管与整个血管纵轴方向呈0°~30°
Ⅱ度(中度)迂曲: 局部血管与整个血管纵轴方向呈30°~60°
Ⅲ度(重度)迂曲: 局部血管与整个血管纵轴方向呈60°~90°
IV度(极重度)迂曲: 局部血管与整个血管纵轴方向成角>90°
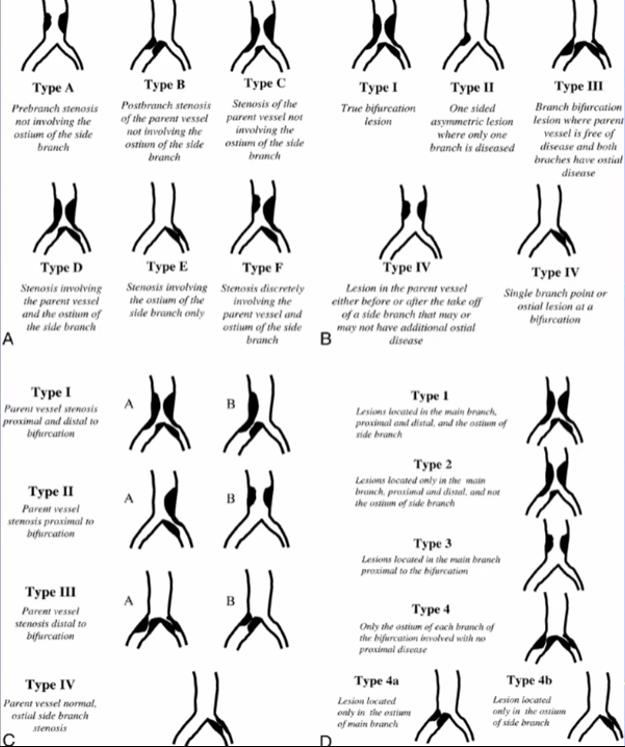
Classification of bifurcation lesions according to plaque burden. A: Duke、B: Sanborn、C: Safian、D: Lefevre
3.冠脉斑块的组织学分类
软斑块病变、钙化病变、溃疡病变、瘤样病变、夹层病变、血栓病变、冠脉痉挛、冠脉肌桥。
钙化病变分级
I度(轻度)钙化: 心脏透视或注射造影剂造影前能模糊看到冠状动脉血管影和走形,但不能清晰地看到血管轮廓,注射造影剂后血管钙化模糊影消失。
Ⅱ度(中度)钙化: 心脏透视或注射造影剂造影前能基本看到冠状动脉血管影和走形,而且能基本看清冠状动脉血管的轮廓,造影剂能完全覆盖血管阴影。
Ⅲ度(重度)钙化: 心脏透视或注射造影剂造影前能清楚地看到冠状动脉血管影和走形,冠状动脉血管轮廓清晰可见,造影时造影剂能部分覆盖血管阴影。
IV度(极重度)钙化: 心脏透视或注射造影剂造影前冠状动脉血管影、轮廓和走形完全清晰可见,是否注射造影剂与血管阴影密度变化不大。
左主干局限性同心性病变
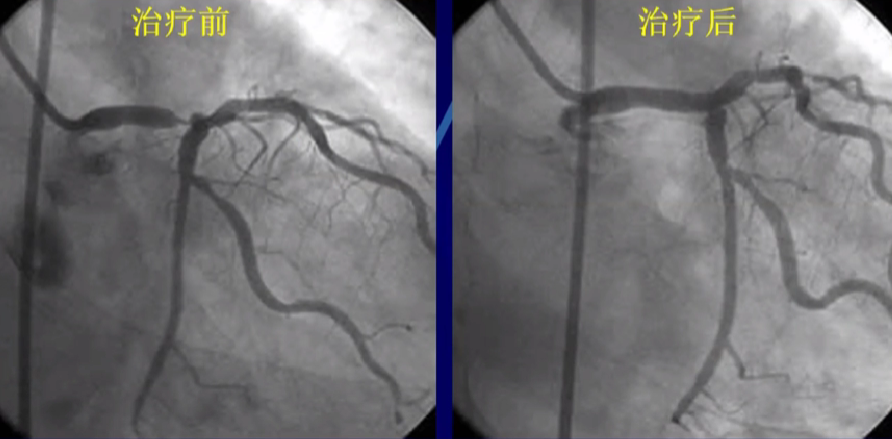
成角病变
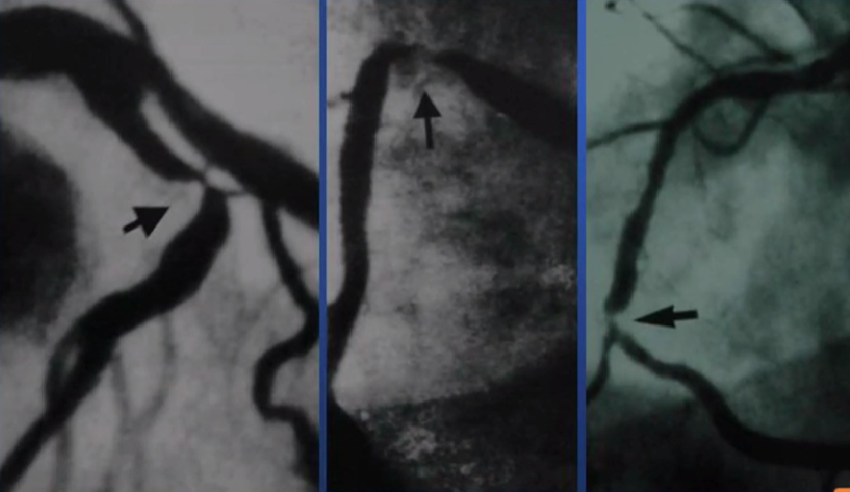
溃疡及偏心病变

迂曲病变
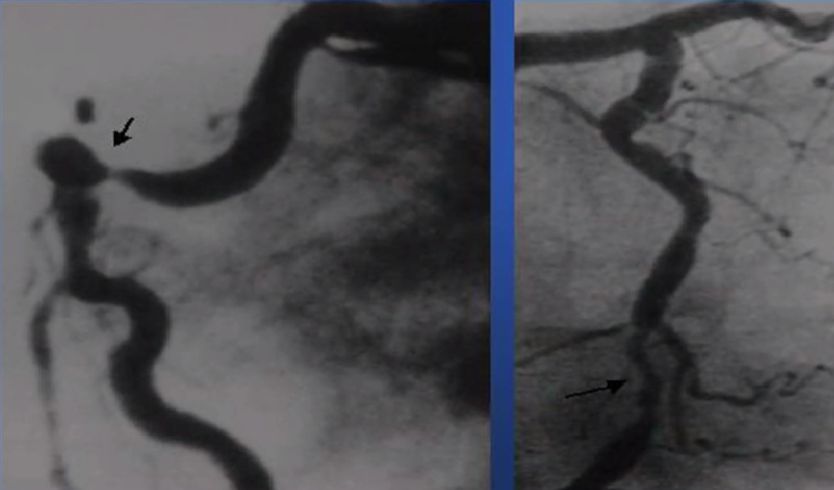
弥漫病变
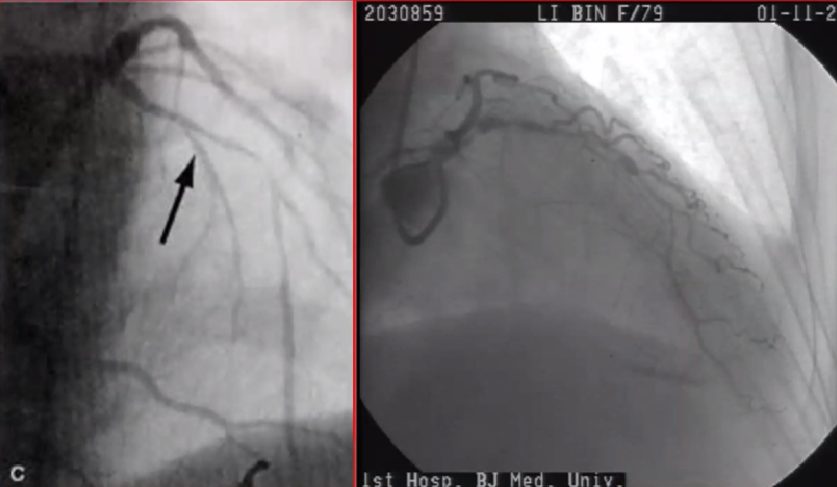
血栓病变
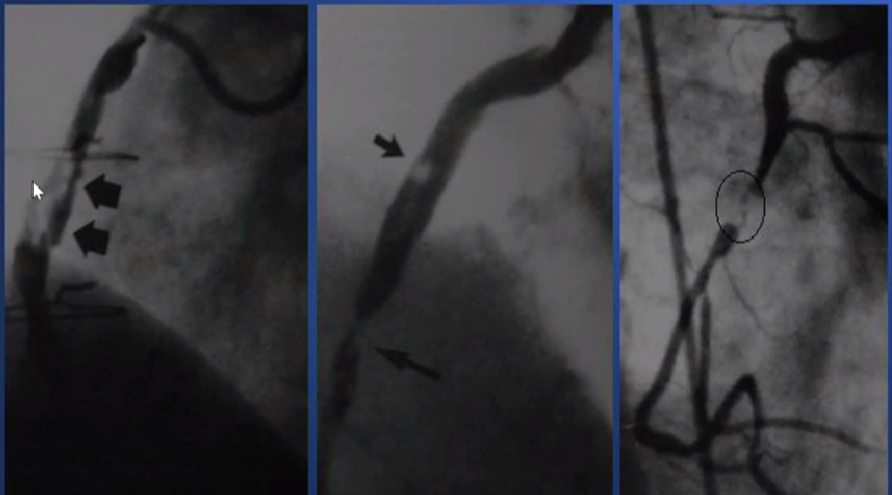
冠状动脉痉挛
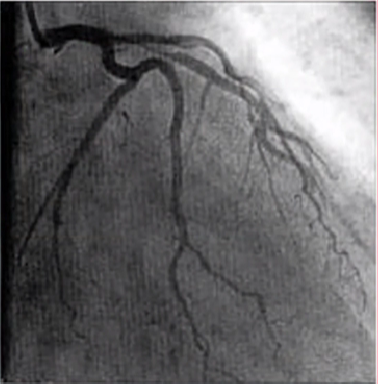
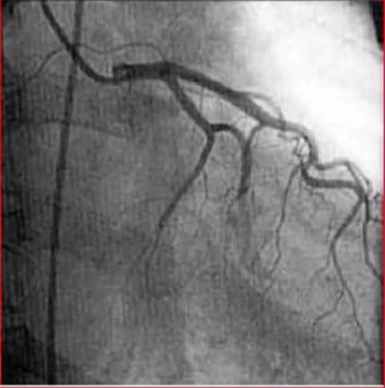
夹层病变
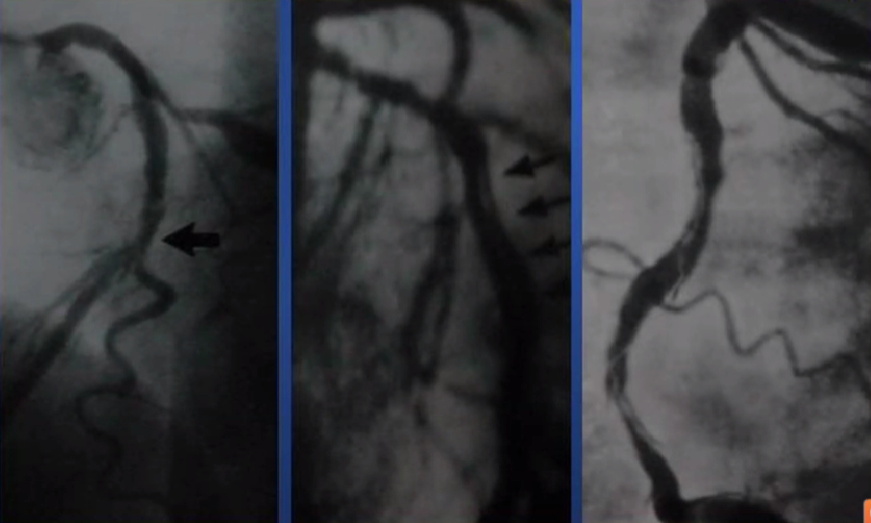
分叉病变
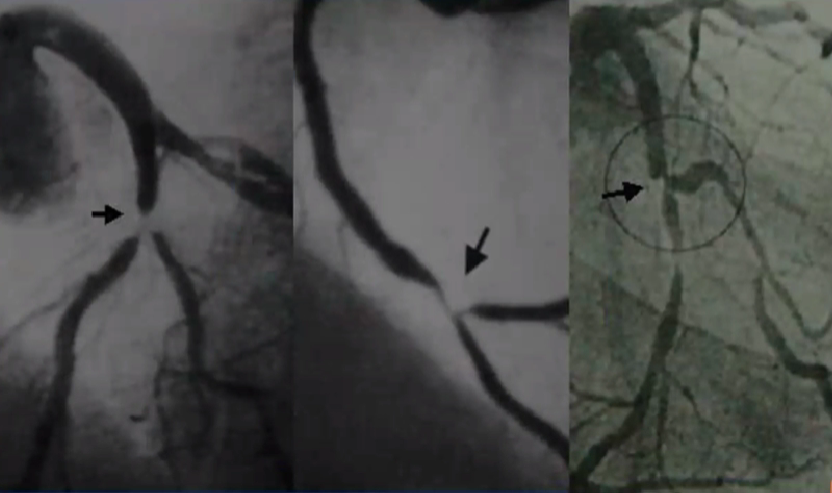
4、分叉病变——铲雪效应
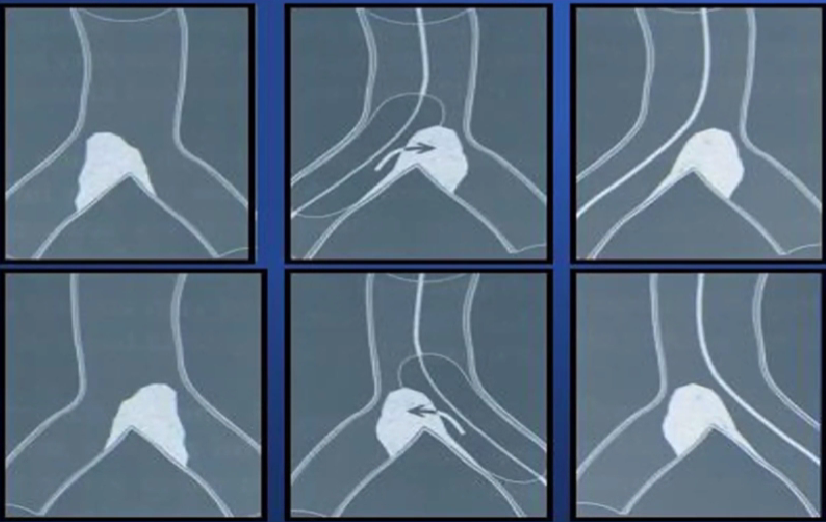
5、对吻球囊
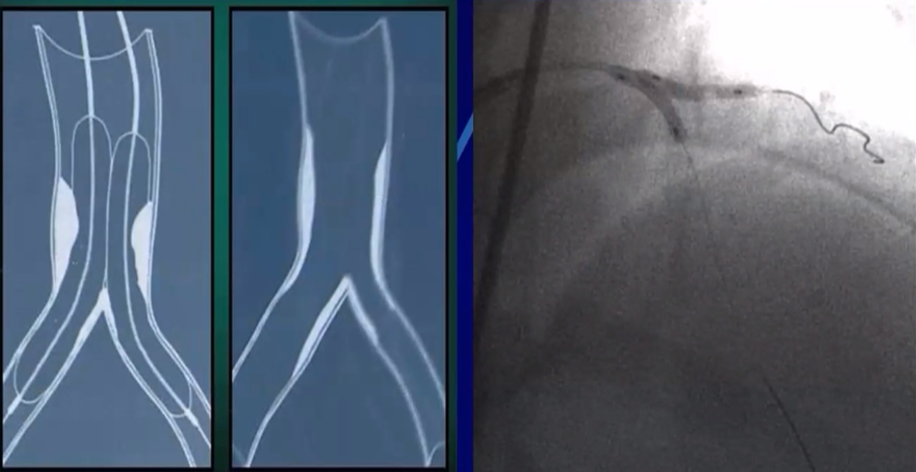
6、冠脉血流分级
TIMI分级 (Thrombolysis in Myocardial Infarction Trail, TlMl);
TIMI 0级: 闭塞远端血管无血流;
TIMI 1级: 病变远端血管有前向血流,但不能充盈远端血管床;
TIMI 2级: 造影剂能缓慢充盈远端血管床(>3个心动周期);
TIMI 3级: 造影剂迅速充盈和清除(<3个心动周期);
7、冠脉造影正常的心绞痛
X综合征: 严格的X综合征的诊断必须:
(1)临床上有典型的劳力性心绞痛;
(2)心电图运动试验阳性;
(3)CAG正常;
(4)麦角胺诱发试验阴性。
机理未完全明确,可能与冠状动脉微血管病变,导致冠状动脉贮备功能下降有关。
变异型心绞痛: 发作时心电图有关导联ST段抬高与之相对应的导联ST段压低。为冠状动脉突然痉挛所致。
冠状动脉血流缓慢综合征: 造影正常的冠状动脉在2个心动周期内,造影剂不能完全充盈整个冠脉系统的现象。机理不明,有人认为系冠状动脉微循环灌注障碍所致
8、冠脉造影的局限性
1、CAG仅能显示被造影剂充填的管腔,而不能显示管壁的病变;对冠状动脉粥样硬化的检出率不高,CAG正常的冠状动脉,尸检经常发现广泛的动脉粥样硬化;
2、CAG对管壁斑块的形态与性质诊断存在一定局限,IVUS在此方面明显优于CAG;
3、对小血管病变不能提供诊断依据: X综合征、高血压和糖尿病的微血管病变;
4、多种因素影响冠脉造影结果分析的精确性,往往是对严重的冠状动脉病变低估其狭窄程度。
9、经皮冠脉介入治疗
定义: 所有经介入途径减轻冠脉狭窄的技术,包括PTCA,Stents,旋切,旋磨,激光血管成形术等。
PCI术成功的定义: 影像、技术、临床
影像: 残余狭窄<20%,TIMI血流3级
技术: 住院期间无主要临床并发症发生
临床: 短期: 影像及技术成功,且无心肌缺血的症状及体征;长期: 持续6个月以上。
PCI成功/并发症的预测因子(AHS/ACC)

临床因素
高龄、女性、不稳定性心绞痛、CHF、糖尿病;
年龄增大,伴随疾病增加,风险增加; 支架植入可降低风险;
PCI治疗的基本机制
1、血管塑形(remodleing): 球囊成形术及支架等使斑块或血栓变形、挤碎、撕裂,冠脉管腔的形态发生改变。
2、去除斑块(removing): 旋切及旋磨等,去除造成阻塞的斑块或血栓,达到使管腔扩大的目的。
球囊成形术
机制: 斑块压缩; 斑块破裂; 偏心病变无病变血管壁扩张; 病变冠脉均衡扩张并伴有斑块的轻微压缩; 斑块碎裂、撕裂伴局部管壁分离。
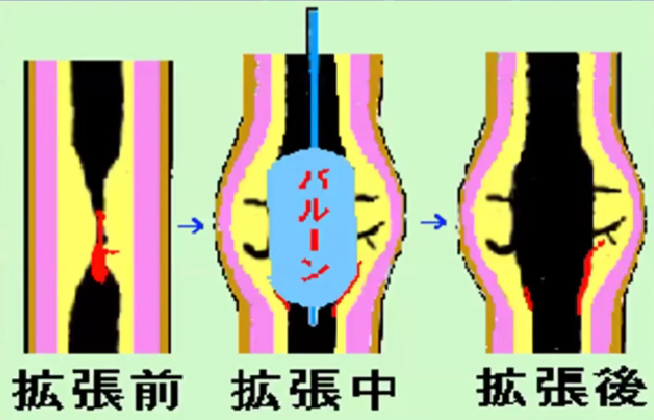
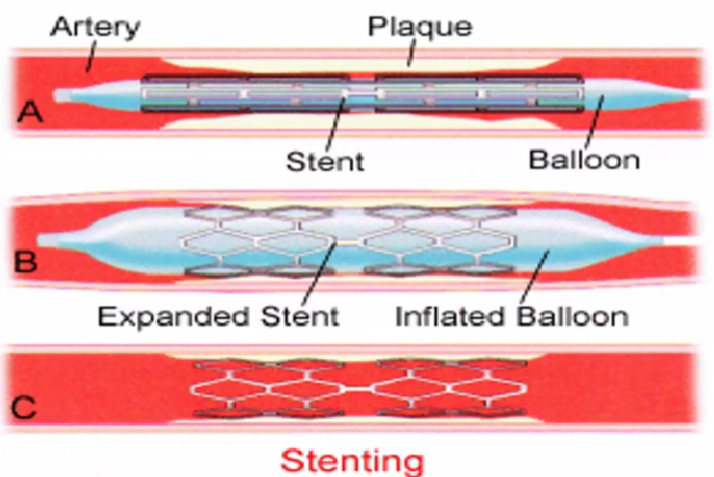
支架植入术
1986年Sigwart首次应用于临床,目前已取代单纯PTCA成为PCI首选。
-END-
声明:本文素材来源于<好医术经典课>,课程讲师郑晓晖,内容仅代表作者个人观点,仅用于学习交流,望大家理性判断及应用。













