文章信息
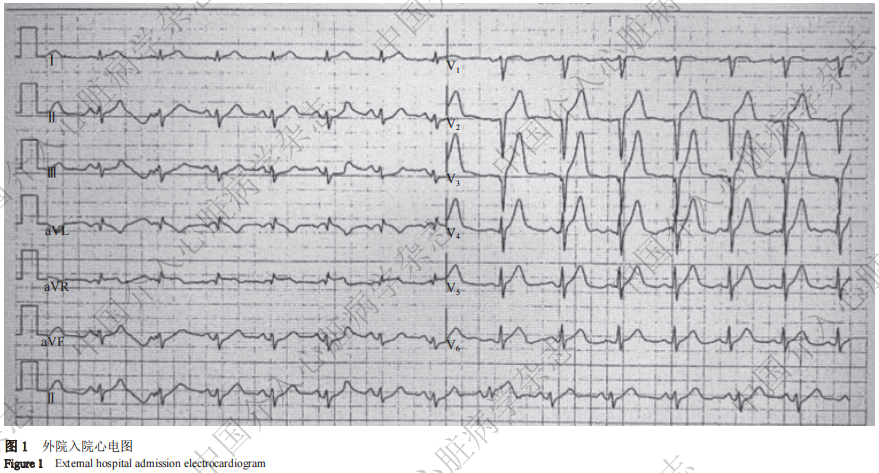
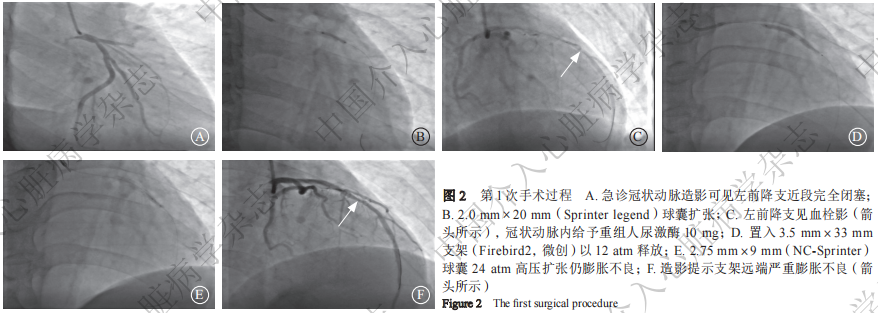
患者 男,44岁。因“反复胸痛3 d,加重3 h”于2024年4月18日入中国科学技术大学附属第一医院。患者3 d前活动后出现心前区疼痛,持续约几分钟可缓解,2024年4月17日23﹕10分左右胸痛加重,持续不能缓解,伴有大汗、恶心呕吐,就诊亳州市人民医院。既往有吸烟史20多年,20支/天。入院查体:神清,血压127/68 mmHg(1mmHg=0.133 kPa),心率83次/分,双肺呼吸音清,心律齐,各瓣膜区未闻及杂音。急诊心电图示(图1):V2~V5 T波高尖伴aVL导联ST段抬高。入院后急诊行冠状动脉造影示:左前降支近段急性完全闭塞(图2A),左回旋支未见明显狭窄,右冠状动脉未见明显狭窄。2024年4月18日外院急诊行冠状动脉介入手术(第1次手术),6 F EBU 3.5指引导管(美国Medtronic公司)送至左冠状动脉口, Runthrough NS导丝(日本Terumo公司)送至左前降支远端,选用2.0 mm×20 mm(Sprinter legend)和2.5 mm×15 mm(NC-Sprinter)球囊均以12 atm(1 atm=101.325 kPa)预扩张靶病变后(图2B),复查造影可见左前降支血栓影(图2C)。冠状动脉内用重组人尿激酶10 mg溶解于20 ml生理盐水,10 min推完。置入3.5 mm×33 mm支架(Firebird2,微创),以12 atm压力释放(图2D),造影提示支架远端严重膨胀不良,选用3.5 mm×12 mm NC-Sprinter球囊不能通过远端支架,2.75 mm×9 mm NC-Sprinter球囊24 atm高压扩张后,支架仍膨胀不良(图2E),最后造影显示支架远端严重膨胀不良(图2F),紧急转院至中国科学技术大学附属第一医院。
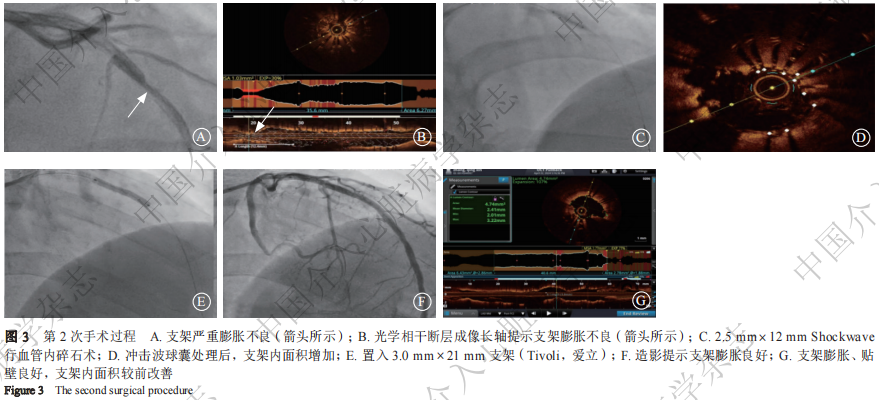
入院查体:神情,精神可,血压115/63 mmHg,心率82次/分,双肺呼吸音清,心脏瓣膜未闻及杂音。实验室检查示:白细胞计数14.03×109/L,红细胞计数4.77×1012/L,血红蛋白126 g/L,血小板计数253×1012/L;肌钙蛋白I(troponin I,TnI)3.08 ng/ml,肌酸激酶同工酶58 IU/L,肌酸激酶274 IU/L,N末端B型脑钠肽前体(amino-terminal probrain natriuretic peptide,NT-proBNP)2 172 pg/ml;三酰甘油0.85 mmol/L,总胆固醇4.08 mmol/L,低密度脂蛋白胆固醇2.34 mmol/L;凝血功能、肝肾功能、电解质、血糖未见异常。入院超声心动图示:左心室舒张末期内径52 mm,左心室射血分数(left ventricular ejection fraction,LVEF)46%。予阿司匹林、替格瑞洛、低分子肝素钠等治疗后,于4月22日(第2次手术)行冠状动脉造影示:左前降支支架远端膨胀不良(图3A)。选用EBU 3.5指引导管到达左冠状动脉口,Runthrough NS导丝(日本Terumo公司)送至左前降支远端,光学相干断层成像(optical coherence tomography,OCT)示:左前降支支架远端严重膨胀不良,管腔可见钙化斑块,最小支架面积(minimum stent area,MSA)为1.1 mm2(图3B)。选用2.5 mm×12 mm 冲击波球囊(Shockwave,美国Genesis医疗公司),以4 atm 扩张,触发10次冲击波脉冲松解钙化斑块,然后充盈压升至6 atm球囊泄压,共循环6个周期(图3C)。再次OCT检查示:支架远端膨胀明显改善,远端钙化环断裂,MSA为3.43 mm2(图3D),再用2.75 mm×12 mm NC-Sprinter高压球囊以22 atm后扩张,原支架远端落脚处合并有斑块狭窄,于远端置入3.0 mm×21 mm支架(Tivoli,爱立),以12 atm压力释放(图3E),分别选用3.0 mm×12 mm、3.5 mm×12 mm NC-Sprinter高压球囊以20 atm扩张,复查造影显示支架膨胀良好(图3F),OCT检查支架贴壁及膨胀良好,MSA为4.74 mm2,远端无夹层(图3G)。
术后第2天出院。2个月后门诊随访,患者主诉无不适。
动态影像资料
冠状动脉严重钙化病变是经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的难点,尤其是重度钙化病变通常不能被充分扩张,支架输送至靶病变位置也存在一定的困难,即使是支架置入后也会出现支架膨胀不良,导致手术成功率降低,围术期并发症高,急性或亚急性支架内血栓形成及再狭窄率增高。这类病变不仅会引起围术期冠状动脉血管夹层、血管破裂等并发症发生,而且导致远期主要不良心血管事件(major adverse cardiovascular events,MACE)增加,严重影响患者预后。冠状动脉钙化与人口老龄化、慢性肾病、吸烟以及糖尿病等因素密切相关。研究显示,接受PCI患者中严重钙化病变占比为20%~30%,急性冠状动脉综合征患者罪犯病变由钙化病变所致占12.7% ,以浅层钙化多见,左前降支为最常累及血管 。严重钙化是PCI失败的独立危险因素,因此支架置入前的钙化病变充分预处理显得非常重要。尽管目前有众多可用于钙化病变预处理的工具和方法(非顺应性球囊、切割球囊、冠状动脉内旋磨术、准分子激光冠状动脉斑块消蚀术等),但在PCI术中仍会经常出现急性支架膨胀不良的问题 。支架膨胀不良是支架内血栓形成和支架内再狭窄的重要危险因素,增加MACE发生率。目前对于钙化病变导致的支架膨胀不良的处理并无有效应对策略,也无明确的相关共识或指南。
近年来经皮冠状动脉腔内冲击波球囊导管成形术,又称为冠状动脉血管内碎石术(intravascular lithotripsy,IVL)已成为处理严重钙化病变的新手段,DISRUPT CAD系列研究证明了其在严重钙化病变预处理中的有效性和安全性。目前已在国内外临床实践中应用。但IVL对于钙化病变所致支架膨胀不良的处理,相关文献报道较少,目前为止,国内仅首都医科大学附属北京安贞医院今年4月报道2例心绞痛患者支架置入后急性支架膨胀不良,应用IVL治疗后MSA均有较大增加,并在短期和中期随访中无MACE发生。但在急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)中急性支架膨胀不良应用IVL,国内个案报道罕见。国际上STEMI中使用IVL的经验也极其有限。本例患者STEMI且冠状动脉病变内有血栓,虽然《冠状动脉钙化病变诊治中国专家共识(2021版)》将血栓病变列为IVL禁忌证,但本例患者在第1次急诊PCI时,予冠状动脉内重组人尿激酶溶栓,考虑患者支架严重膨胀不良,急性支架内血栓形成风险较高,故转入我院选择强化药物治疗3 d后,行IVL治疗支架膨胀不良。《经皮冠状动脉腔内冲击波球囊导管成形术临床应用中国专家建议》:靶血管正常参考直径与IVL球囊直径选择应为1﹕1,但该患者支架严重膨胀不良,行OCT检查提示支架严重膨胀不良处管腔直径仅为2.4 mm左右,且外院第1次手术2.75 mm非顺应性球囊难以通过,故选择2.5 mm直径冲击波球囊。若第1次PCI中应用切割球囊进行预处理,可能支架膨胀会更好。最终手术过程安全有效,术中未见无复流、慢血流发生,术后MSA明显增加,患者在2个月后门诊随访中无不适和MACE发生。提示严重钙化病变合并血栓,可以考虑充分抗凝治疗后择期行IVL治疗。但需要注意的是,IVL可能对支架梁的完整性、药物涂层有影响,仍有待进一步研究。目前对于IVL在支架膨胀不良中应用的报道主要来自于个案报道、较小样本量的观察性研究,需要更多的大样本研究来进一步证实。
参考文献:略
-END-
声明:本文转载于<中国介入心脏病学杂志>,以上仅代表作者本人观点,仅用于学习交流,版权归原作者所有。