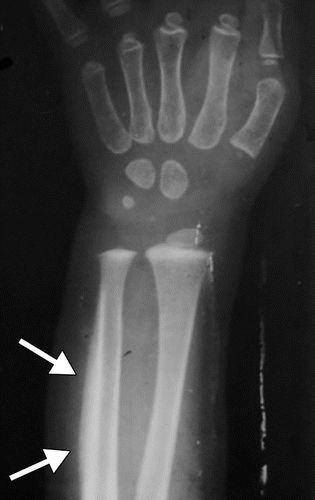
肥大性骨关节病(hypertrophic osteoarthropathy,HOA)是一种由于骨周围软组织增厚,广泛性骨膜新骨形成而导致的综合征。临床以杵状指(趾)、广泛性骨膜新骨形成和关节疼痛、积液为主要表现。
肥大性骨关节病分为原发性和继发性两类,原发性肥大性骨关节病也称为家族性肥大性骨关节病、厚皮性骨膜病(pachydermoperiostosis),男性好发,男女比例为8.9∶1,约2/3 以上的患者在初生时或15 岁左右两个高峰年龄发病。可并发关节积液,骨髓纤维化、胃肠增生性病变及染色体异常等。原发性肥大性骨关节病属于自限性疾病,在少年及青春期活跃,至成年进入无症状的稳定期。
继发性肥大性骨关节病又称为肺性肥大性骨关节病(pulmonary HOA),往往有明显的内脏疾病,发病年龄一般较大,以中老年为主,比较多见。可并发肺和胸膜疾病、心血管疾病和胸腔外疾病等。继发性肥大性骨关节病的发展依赖于其原发性疾病,去除原发性疾病,继发性肥大性骨关节病可以缓解或痊愈。
肥厚性骨关节病(HOA)是一种综合征,其特征在于四肢远端部分的皮肤异常增殖,以及长骨的骨膜增生。通常存在三种临床特征:杵状指,管状骨骨膜增生和滑膜积液。
杵状指的特征是指骨/趾骨尖端的局灶性球状畸形,并且常常预示着严重的疾病。这是最古老的临床症状之一:希波克拉底在公元前5世纪描述了患有脓胸和弯曲指甲的患者,因此借用了Hippocratic fingers 和 Hippocrates fingers。有证据表明HOA在整个时间和哺乳动物物种中无处不在。古生物学研究已经证明,从前西班牙时期的中美洲和中世纪匈牙利考古的骨骼遗骸,发现与社区管理相一致的HOA变化。甚至报道了犬科动物和牛科动物的HOA,显然与人类报道的疾病相同的疾病。
HOA作为主要遗传性疾病存在,或者可能继发于多种病理过程。临床和放射学表现是多种多样的,并且通常是非特异性的,使其成为放射科医师和转诊医师的诊断挑战。它与肺和非肺部疾病,特别是恶性肿瘤的潜在关联,强调了识别这种疾病的重要性。
(一)HOA的分类和命名:
关于杵状指和HOA的命名法(表1),围绕术语经常存在混淆;特别是因为HOA可以是主要或次要实体(图1)。
表一:杵状指和HOA的命名法
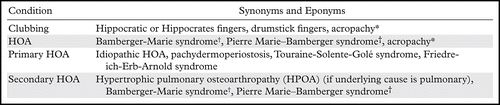
* Acropachy(杵状指; 肢端肥大病),本身可能指的是杵状指或完全发展的HOA综合征。另一方面,甲状腺acropachy特别发生在甲状腺疾病的环境中,是在开始治疗Graves病之后。
†Bamberger-Marie综合征和Pierre Marie-Bamberger综合征已被不同作者用于指最广泛意义上的HOA和二级HOA。
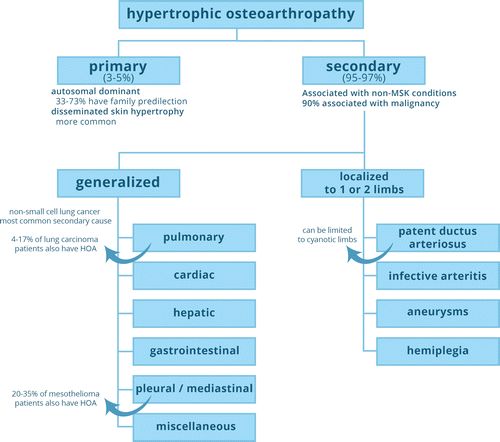
图1. HOA的分类。MSK =肌肉骨骼。
杵状指(clubbing)的同义词包括 Hippocrates fingers、 Hippocratic fingers和鼓槌指(drumstick fingers)。在最广泛的意义上,没有指定原发或继发的HOA也被称为Bamberger-Marie 综合征或Pierre Marie–Bamberger 综合征。然而,许多作者使用这两个名称来指代继发HOA。Pierre Marie和Eugen von Bamberger分别在1890年和1891年描述了该综合征,将其与肢端肥大症区别开来。
acropachy(希腊语中的“thick extremity”)本身可能指的是杵状指或HOA综合征。另一方面,甲状腺acropachy特别是指在甲状腺疾病的环境中,特别是在治疗Graves病后的HOA。
原发性HOA是一种罕见的遗传性疾病,通常在儿童期或青春期早期发病,男性偏好(男女比例约为7:1),在非裔美国人中更为常见。它也被称为特发性HOA,骨膜增生性厚皮症(pachydermoperiostosis),Touraine-Solente-Golé综合征和Friedreich-Erb-Arnold综合征。33%至73%的患者有近亲患有同一疾病。弥散性皮肤肥大( Disseminated skin hypertrophy )是原发性HOA的特征,因此称为骨膜增生性厚皮症。1868年,Nikolaus Friedreich,Wilhelm Heinrich Erb和Julius Arnold在两兄弟中描述了“整个骨骼的骨质增生”。1935年,Albert Touraine,Gabriel Solente和LaurentGolé将初级HOA与次要形式区分开来,详细描述了该疾病的三种临床亚型。
继发性HOA绝对比原发性HOA更常见,占所有病例的95%-97%,并且与广谱的骨外病症相关。如果潜在的病症,例如非小细胞肺癌或囊性纤维化,起源于肺部,则可以应用Marie所创造的肥厚性肺部骨关节病这一术语。然而,重要的是要注意,心血管,胸膜和纵隔原因也已被描述,甚至诸如肝硬化和炎性肠病的胸外疾病也可能是继发性HOA的原因(表2)。
表2:HOA的原因
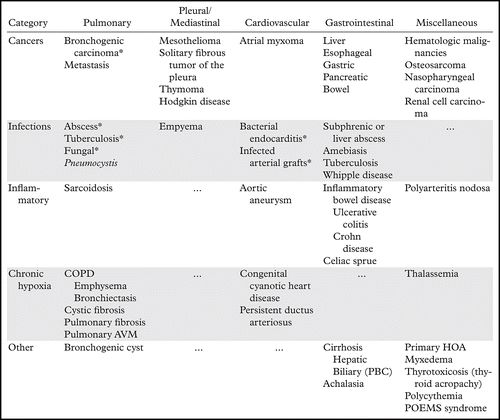
注意-AVM =动静脉畸形,COPD =慢性阻塞性肺病,PBC =原发性胆汁性肝硬化,POEMS =多发性神经病,器官肿大,内分泌病,单克隆蛋白和皮肤改变。
(二)最常见的原因:
由于全身性疾病和限于一个或两个肢体的局部形式,继发性HOA还可以进一步分类为全身形式,通常由于突出的内皮损伤(例如,动脉瘤)。此外,HOA可限于动脉导管未闭并发肺动脉高压的肢体紫绀,并可单侧表现为动脉移植物感染或功能性动静脉瘘。
(三)HOA的发病机制和病因
HOA发病机制的确切机制尚不清楚。目前存在两种模型:神经源性途径和体液途径。
在HOA的神经源性途径模型中,由迷走神经支配的患病器官可以诱导神经反射,导致血管舒张和增加到四肢的血流。据报道,化学迷走神经切断术(Chemical vagotomy)与阿托品和外科迷走神经切断术(atropine and surgical vagotomy )作为症状缓解的尝试取得了不同的成功。
在HOA的体液途径模型中,细胞因子和生长因子,包括血小板衍生生长因子(PDGF),前列腺素E2(PGE2)和血管内皮生长因子(VEGF),已经涉及分子水平。这些体液因子中有许多是缺氧诱导的药物,这可能是导致不同缺氧和恶性疾病中杵状指存在的原因。体液途径模型得到以下事实的进一步支持:先天性心脏病的新生儿给予前列腺素以保持动脉导管的通畅,经常发生骨膜新骨形成(前列腺素诱导的骨膜炎),涉及长骨的2-8周内的骨干。以与HOA所见相同的模式开始输注,在停止输注后1-5个月解决该发现。
1)原发HOA:
在具有原发性HOA的家族中的基因组研究已经鉴定出涉及15-羟基前列腺素脱氢酶基因(HPGD)和溶质载体有机阴离子转运蛋白家族成员2A1基因(SLCO2A1)的突变,两者都负责PGE2的降解。受影响的个体表现出长期升高的PGE2水平,这可能导致VEGF的过度表达及其对成骨细胞的影响,导致过度的新骨形成。该疾病表现出不同的表达能力,并且已经提出了厚皮动脉硬化症的常染色体显性遗传和隐性遗传。
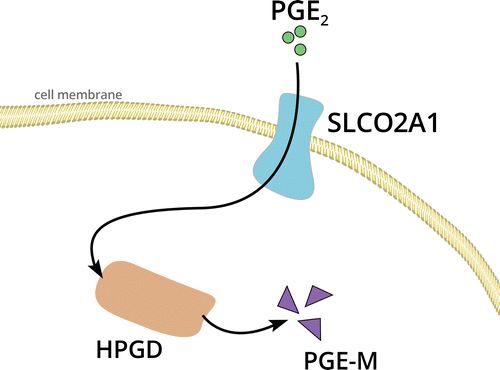
图2.HPGD和SLCO2A1基因的蛋白质产物,在膜转运和PGE2代谢为其代谢物13,14-二氢-15-酮 - 前列腺素E2(PGE-M)中的作用。已经在具有原发性HOA的个体中鉴定了这两个基因中的突变,这意味着PGE 2在骨膜增生和杵状指的过程中起重要作用。
2)继发HOA
广泛性继发性HOA的大多数病例与肺功能的改变有关,或者是肺肿瘤,肺实质损伤(例如,间质性肺病),或者肺部从循环中排除(例如,紫绀型心脏病)。高水平的生长因子可能以两种假设方式积聚在外周循环中(图3)。
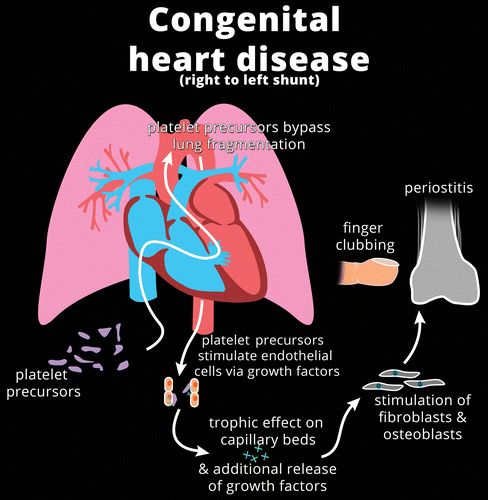
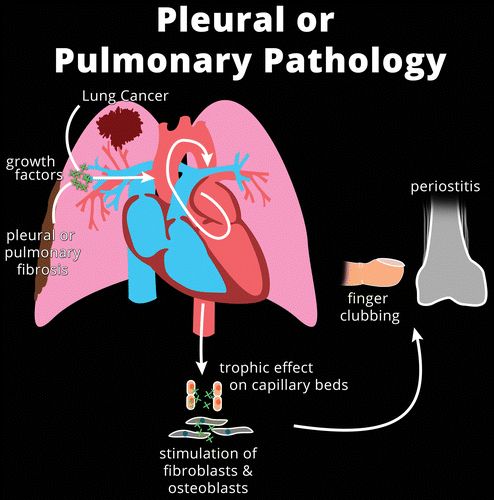
图3. 插图显示先天性心脏病患者HOA发病机制的假设机制,具有右向左分流(a)由于肺循环内未破坏血小板前体,或胸膜或肺部疾病(b)导致生长因子释放和对毛细血管床的营养作用,在两种情况下均促进血管分布和成纤维细胞和成骨细胞的刺激,并导致骨膜炎和手指杵状指。
首先,在存在心内分流(例如,法洛四联症)或肺内分流(例如,肝肺综合征)的情况下,血小板前体不能在肺循环内碎裂而是进入体循环。由于血小板碎片在四肢的外周毛细血管中被捕获,生长因子的释放促进血管分布和成纤维细胞活性,因此导致软组织和骨形成。分流还可以解释用于血液透析的手臂中的动静脉瘘,如何将这些生长因子从外围转移并保护同侧手免受HOA的影响。
其次,在肺纤维化,肺癌或胸膜孤立性纤维性肿瘤的情况下,生长因子可能会被异常组织释放并进入体循环以诱导肢端。由局部病理过程产生或激活的血管活性因子的系统传播,也可能在HOA的体液途径中起作用。被感染的血管移植物中的细菌产生的内毒素可能是下肢单侧HOA的原因。
在组织学水平,过度的胶原沉积,血管舒张,血管增生和间质水肿导致杵状指中指骨的球状畸形。 骨骼外部过多的结缔组织导致骨膜的升高和下面新的类骨质基质的沉积。
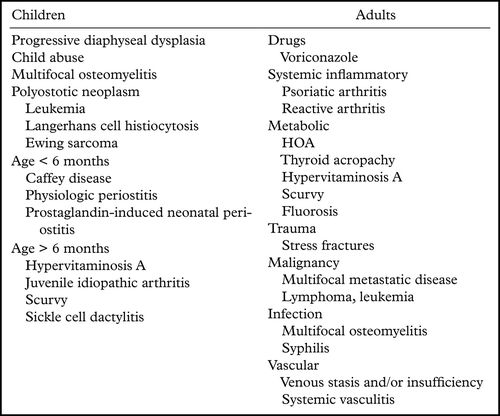
HOA可以继发于涉及不同器官系统的各种病症(表2)。
虽然继发性HOA最常与胸内疾病相关,但重要的是要注意其与非肺部疾病的关系,并避免将所有继发性HOA病例标记为肥厚性肺部骨关节病的缺陷。
HOA的最常见原因是非小细胞肺癌(NSCLC)。据报道,肺癌中HOA的发生率在4%至17%之间。由于其他肿瘤,包括胸膜孤立性纤维性肿瘤,HOA也可能是副肿瘤综合征。事实上,HOA被报道为胸膜孤立性纤维瘤患者中22%的副肿瘤综合征,而肺癌的患病率仅为约5%,尽管肺癌仍然是继发性HOA的最常见原因。鉴于其总体患病率增加。据报道,骨膜炎或HOA可以在这些潜在的疾病之前几个月。
儿童HOA更常见于非肿瘤性原因,如细菌性心内膜炎和先天性心脏病,以及囊性纤维化,慢性气道感染和其他慢性肺病。据我们所知,迄今为止仅有34例患者报告肿瘤性疾病是儿科HOA的原因:鼻咽癌12例,霍奇金淋巴瘤9例,骨肉瘤8例,胸腺癌3例,骨膜肉瘤1例,胸膜1例间皮瘤。
(四)HOA的临床表现
患有HOA的患者存在连续的体征和症状,并且很少出现杵状指,骨膜增生和滑膜渗出的完整三联征。事实上,患有HOA的患者经常会出现骨膜增生症而没有杵状指或关节疼痛。
在这个范围的一端,患者可能没有症状,也没有意识到他们的指骨/趾骨畸形。另一方面,一些人,尤其是那些患有肺部恶性肿瘤的人,可能会在杵状指之前出现灼烧感和骨痛。除了邻近的关节之外,涉及骨骼的疼痛,临床医生应该多方考虑,远离潜在的炎症性关节炎误诊。
手指的杵状形态表明指尖有明显的球状畸形,可能是大多数HOA病例的唯一表现。水肿和增加的软组织甲床鼓起,导致鼓槌外观。存在几种用于诊断杵状指的方法(图4)。角质层附近的皮肤与指甲的近端起伏之间的Lovibond或轮廓角超过180°,角质层近端皮肤与远端指甲之间的上颌角超过192°,与指骨深度比(DPD与IPD之间) )大于1都被认为是对杵状指的诊断。Schamroth标志(或Schamroth窗口测试)定义为两个并置的钉床之间的菱形窗口的损失。另外,通过首先在DIP关节处和在甲床处测量每个手指的周长然后添加10个钉床到远端指间比来计算数字指数。如果数字指数大于10,则可能存在杵状指。然而,这些体格检查操作和测量证明了观察者之间的可变性。
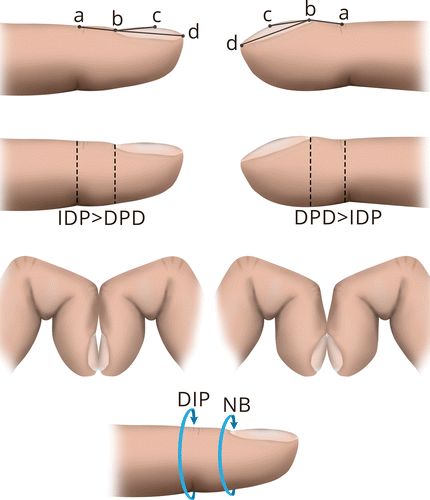
图4.在体检时诊断杵状指的方法包括hyponychial角(角度abc <188°是正常的,左侧,> 192°,有杵状指,右侧),Lovibond或剖面角度(角度abd <165°是正常的,左侧 对于杵状指> 180°,右),指骨深度比(远端指骨深度[DPD] /指间深度[IPD]比率<1为正常,左,并且> 1为杵状指,右),Schamroth征(失去正常) 当指甲放在一起时,甲床之间的菱形窗口,以及指/趾指数(所有手指的甲床周长[NB] /远端指间距[DIP]比率的总和,> 10,用于杵状指)。
虽然诊断不需要,但大关节的积液可能在HOA中出现,但既没有滑膜肥大也没有炎性细胞渗出到滑液中。这些反映了HOA既不是炎症性关节疾病也不是增生性滑膜疾病的事实。有时,关节疼痛症状的双侧对称分布可能误导临床医生误诊早期或非典型类风湿性关节炎。
除上述骨关节症状外,患有原发性HOA或骨膜增生性厚皮症的患者往往伴有播散性皮肤过度生长,可以表现出症状的连续性。已经描述了具有不同程度的骨骼和皮肤受累的不同亚型的骨膜增生性厚皮症:经典或完整形式,具有皮肤和骨骼变化; 一种不完整的形式(incomplete form),具有孤立的骨膜增生症,没有皮肤变化; 和一个不完全形式(forme fruste),有厚皮病,但没有骨骼效应。在这三种原发性HOA亚型中,不完全形式是最常见的。
厚皮病的皮肤表现多种多样。厚皮(Pachydermia),或手的皮肤,前额和背部的增厚是常见的。上睑下垂,以及面部的粗化和皱纹,可以促成狮子面容(leonine)。在晚期,表现皮肤肥厚,回状头皮(cutis verticis gyrata),其特点是头皮褶皱导致斗牛犬头皮外观,虽然这一发现不是厚皮性骨膜病的特异特征。也可能存在圆柱形腿部畸形(称为大象腿),多汗症和皮脂溢。
与继发性HOA相关的其他临床发现可能反映内脏器官的疾病并有助于确定HOA的原因。特别是甲状腺功能障碍患者在开始治疗格雷夫斯病后也往往表现出眼球突出和胫前粘液性水肿。发绀表明存在先天性紫绀型心脏病,较少见的是肺部疾病,如囊性纤维化,肺纤维化和慢性阻塞性肺病。
(五)HOA的成像特征
由于缺乏可靠的HOA血清学检测,成像评估在HOA的诊断中起着重要作用。
1)X线照相和CT:
四肢平片通常是用于评估HOA经常出现的疼痛的第一种成像方式,并且即使在无症状患者中也可能表现出异常。在X射线照片上可以出现软组织发现,例如远端指状物的球状变形,异常的指甲弯曲和软组织肿胀。
在长期杵状指的情况下的骨重塑可导致手指和脚趾的末端趾骨的骨吸收,称为肢端骨质溶解(acro-osteolysis),传统上与原发性HOA和先天性紫绀型心脏病相关。在指骨中也描述了较不频繁的放射照相图案,即绒毛过度生长,据推测,在患有恶性肿瘤的患者中更常见。然而,最近的研究表明这两种模式之间存在相当大的重叠。这两个骨质变化通常首先出现在脚趾上,手指变化靠后。
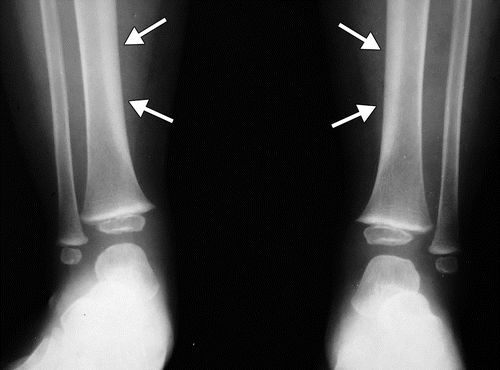
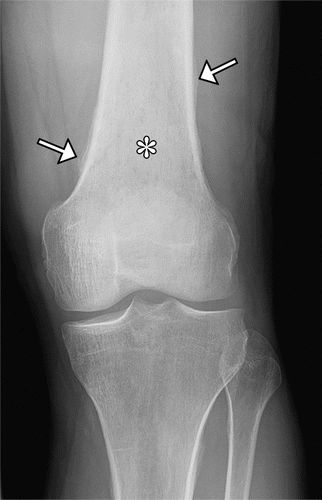
骨膜增生症是HOA的成像标志,沿管状骨的轴呈现,并且通常在最早阶段使骨骺不受影响。骨骺受累在原发性HOA中更常见。对称和广泛分布的骨质受累是原发性和广泛性继发性HOA的典型发现,鉴于其系统性调节(图5)。胫骨,腓骨,桡骨和尺骨是最常受影响的骨骼(图6),然后是手指的指骨(图7)。骨膜反应可以是实心的,线性的,致密的或分层的。
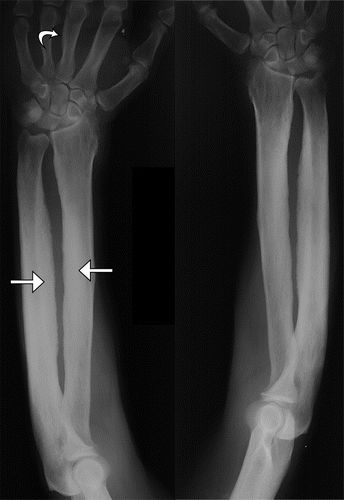
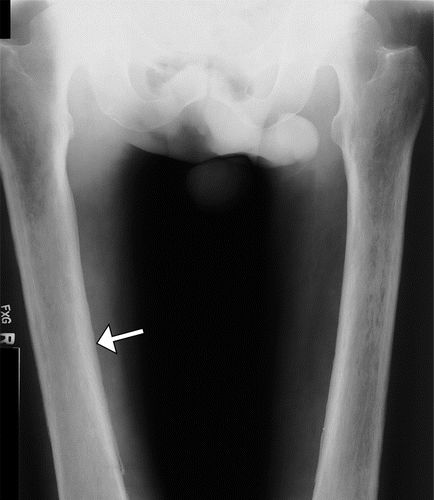
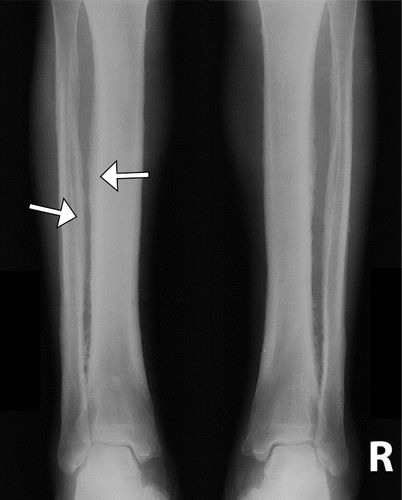
图5.52岁男性,原发性HOA(pachydermoperiostosis),他回忆手脚粗大,14至17岁之间的面部特征粗化,并且在头皮和头皮上有整形手术史。前额涉及脱掉大量皮肤。前臂(a),股骨(b),胫骨和腓骨(c)的前后位(AP)X线片显示双侧对称骨膜增厚(箭头)。(由医学博士Deborah M. Forrester提供。)
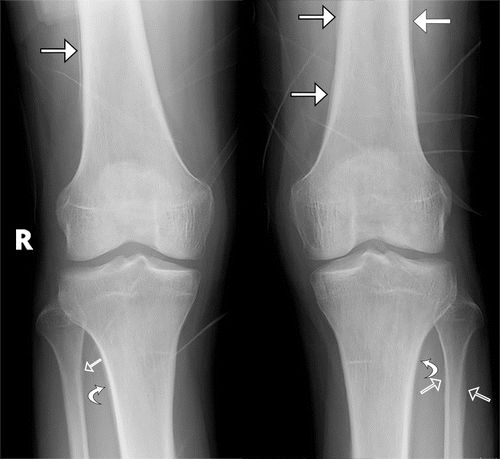
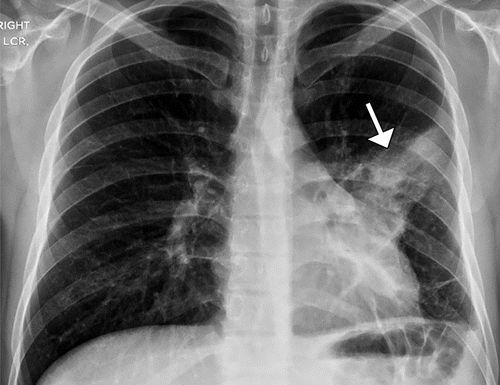
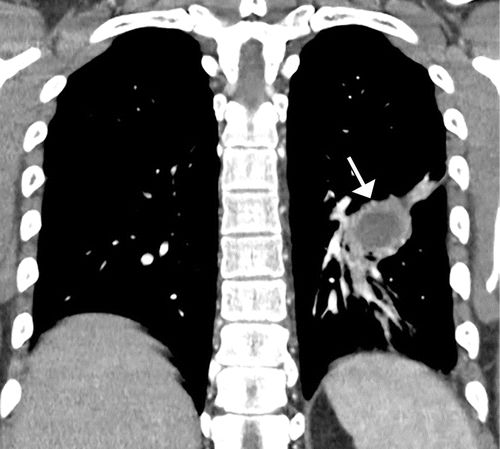
图6.25岁男性患者,出现咳嗽,双侧膝关节和踝关节疼痛,肺脓肿和继发HOA。(a)双侧膝关节的AP射线照片显示沿着远端股骨(直闭箭头),近端胫骨(弯曲箭头)和双侧腓骨(空心箭头)的对称骨膜反应。(b)胸片显示左肺中部区域的不透明度(箭头)区。(c)胸部冠状位CT重建显示左下叶有脓肿(箭头),有不规则的增强囊。
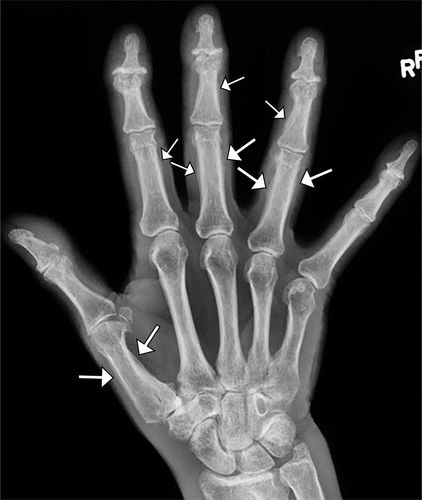
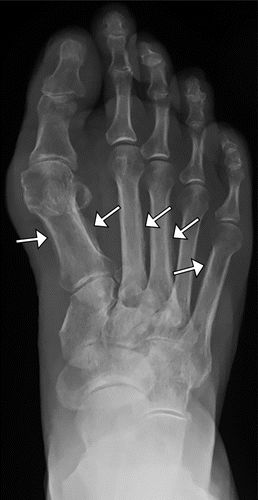
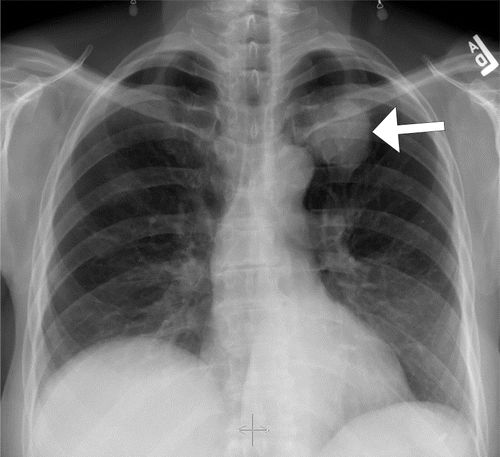
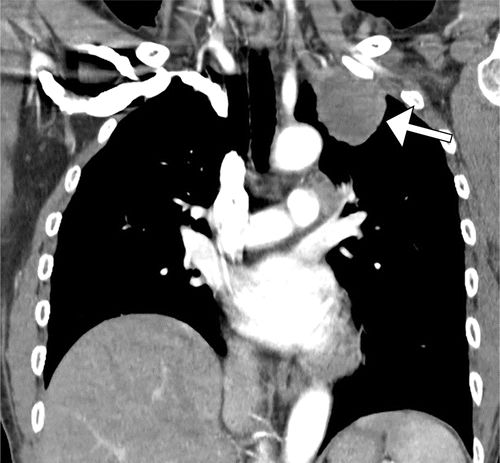
图7.HOA继发于假定的支气管肺癌,一名58岁的女性患者出现手脚疼痛和肿胀。(a)右手(PA)X线片显示第一掌骨和一些近端和中间指骨轴的骨膜反应(箭头)。(b)右脚射线照片显示围绕几个跖骨轴的厚骨膜反应(箭头)。左手和脚(未示出)具有相似的射线照相外观。(c,d)胸部的片(c)和冠状CT重建(d)显示左上叶肿块(箭头)。
HOA中的骨膜周围病变出现在放射线照相中,分三个因素分阶段进展:受影响的骨骼数量,给定骨骼内的受累部位以及绒毛过度生长骨膜反应的形状(表3)。在轻微的情况下,很少有骨头受到影响(通常是胫骨和腓骨); 骨膜周围受限于骨干,并表现出线性单层构型,增加骨骼周长而不改变其形状(图8)。在中度病例中,骨膜增生症可延伸至骨骺并呈层状或多层(图9)。晚期病例可影响所有管状骨:除了骨干外,还可能涉及干骺端和骨骺,并且骨膜周围组织获得不规则的形态。骨膜增生期可能与疾病持续时间相关,而不是HOA的主要或次要性质。
表3:HOA中骨膜增生的阶段
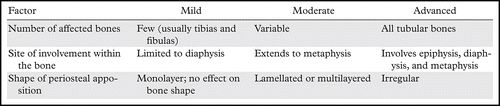
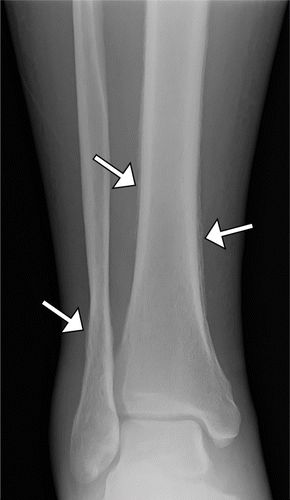
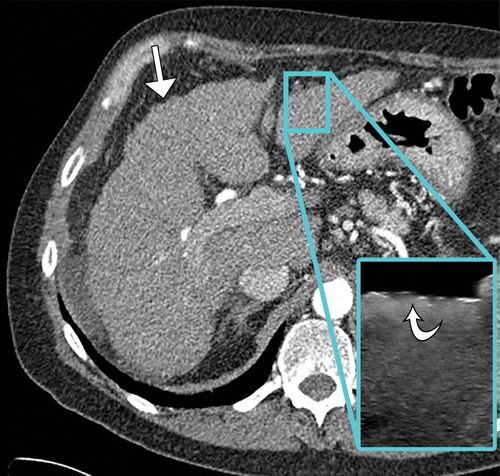
图8.HOA继发于酒精性肝硬化,患有右脚踝疼痛的52岁男性。(a)右胫骨和腓骨的AP射线照片显示远端骨干和两个骨的干骺端的骨膜增生。(b)肝脏表面的轴向CT和超声(US)(插图)图像显示肝脏表面的结节形态(箭头)。
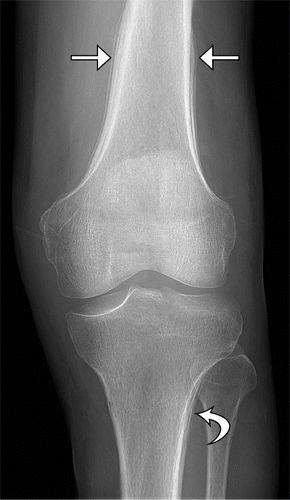
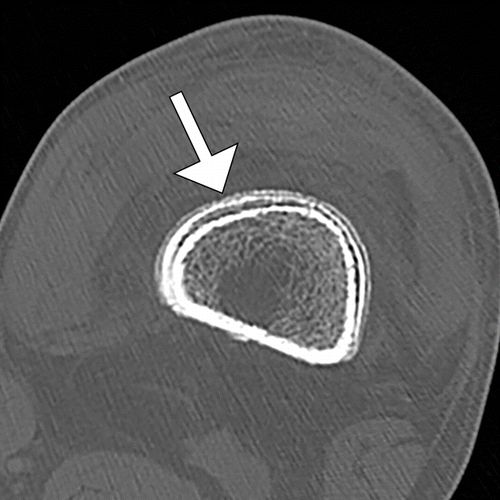
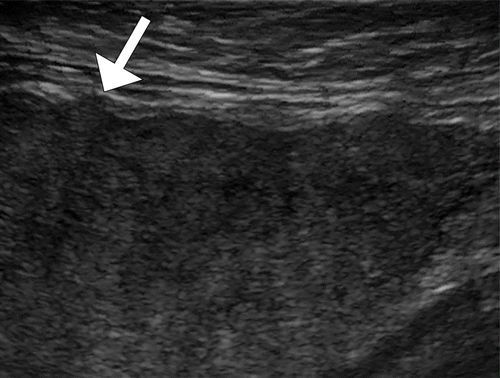
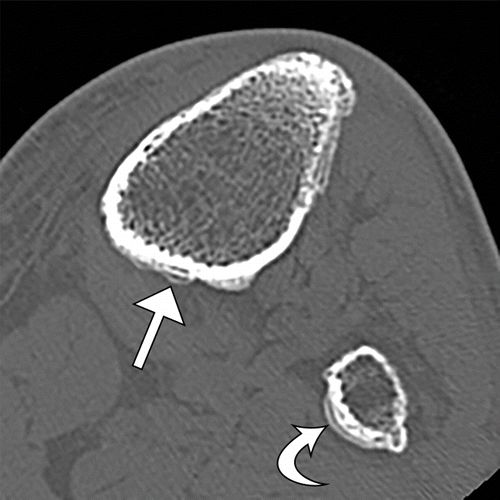
图9.HOA继发于酒精性肝硬化,患有左膝疼痛和肿胀的49岁男性。(a)左膝的AP射线照片显示远端股骨(直箭头)和近端胫骨(弯曲箭头)的骨膜反应。(b,c)左膝的轴向CT图像更清楚地显示了涉及股骨远端的骨膜反应,层状洋葱皮外观(b中的箭头),和涉及胫骨和腓骨近端后表面的固体骨膜反应(c中的直箭头、弯曲箭头)。(d,e)肝脏的US图像显示出结节形态(d中的箭头))肝脏表面和突出的脐旁静脉(e中的箭头),彩色多普勒图像上的流动(e中的插图)表示门静脉高压症。
HOA关节受累由滑膜积液的存在来表征,没有关节间隙变窄,侵蚀或关节周围骨质减少的征象。事实上,由于关节炎通常是HOA的主诉,因此初始X线照片通常以关节空间为中心,放射科医生必须不要忽视X线片的外围,从而错过邻近关节的长骨中的骨膜周围病。
四肢对称性骨膜增生症的存在,特别是在没有潜在的骨质异常(如皮质破坏或骨折)的情况下,应提醒大家在鉴别诊断时考虑继发性HOA并建议胸片检查疑似胸廓异常,尤其是支气管肺癌。如果胸部成像结果为阴性,也应考虑胸外病理状况。
2)磁共振成像
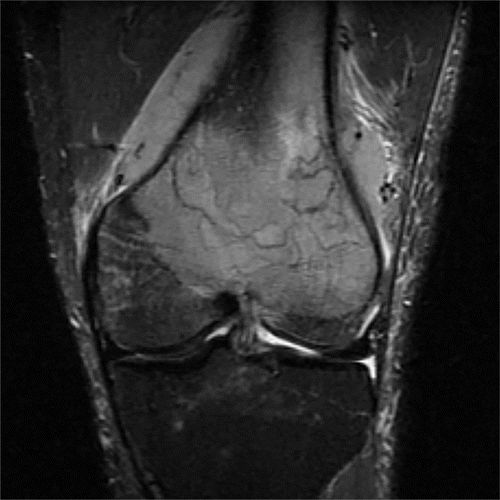
MR成像的骨膜反应通常在T1加权图像上呈现低至中等信号强度,在T2加权图像上呈现低信号强度(图10)。它在MR成像中的出现通常与放射学检查结果相关,并且可以表现为单纯的骨膜隆起或层状或洋葱皮骨膜反应。已经报道了T1加权成像中的中间和低信号强度的交替谱带,分别对应于未成熟和成熟的骨膜。
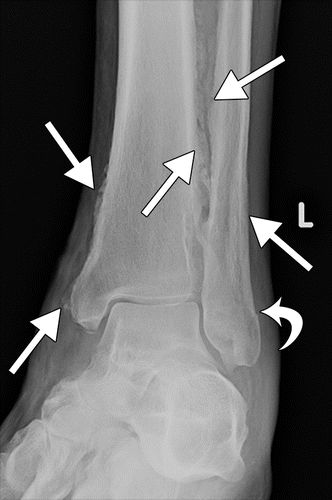
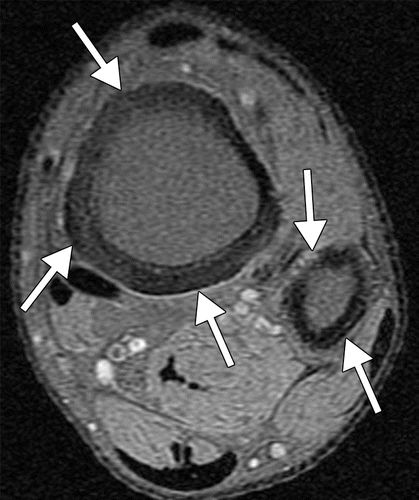
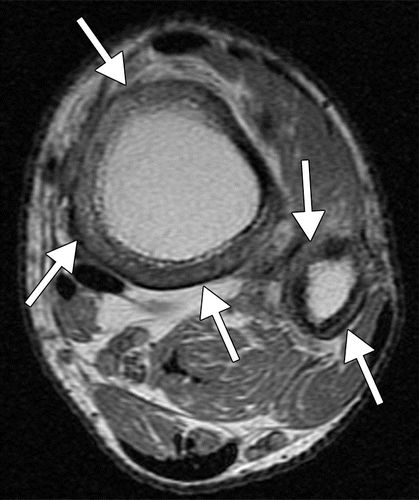
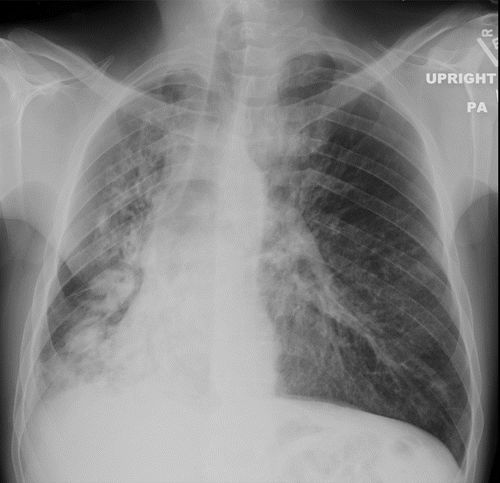
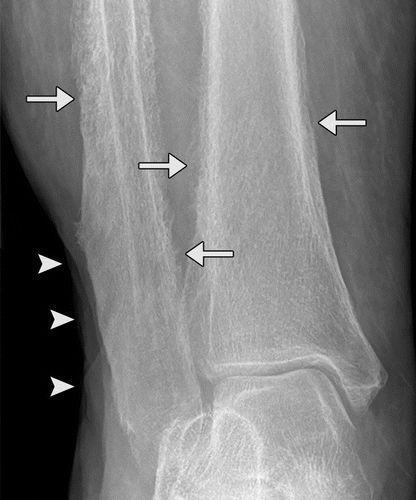
图10.HOA继发于46岁男性的囊性纤维化。(a)左脚踝X线显示远端胫骨和腓骨的多灶性骨膜炎(直箭头)。还注意到外踝的非移位骨折(弯曲箭头)。(b,c)轴向T1加权(b)和STIR(c)MR图像显示远端胫骨和腓骨的近周向中间骨膜增厚(箭头)。(d)PA胸片显示支气管扩张和支气管周围间质增厚伴右侧粘膜堵塞和体积减少。
流体敏感序列,如T2加权,质子密度加权和短τ反转恢复(STIR)成像,往往会表现出精细的低信号线,代表骨膜被高信号强度所包围。也可以看到增厚骨膜的对比度增强。韧带或腱插入部位和骨间膜的骨质增生可在后期显现。
在骨质软组织内T2加权图像上的高信号可能代表软组织反应性变化,并且可能与患者报告的关节周围肿胀的严重性和位置相关。也可能存在肌肉或室间隔水肿。
虽然罕见,但已报告可侵犯髓腔的骨内新骨形成。无论如何,MR成像中骨皮质和髓腔的总体正常信号强度有助于排除潜在的原发性骨感染或恶性肿瘤。据报道,至少有一例继发于肺癌的HOA患者出现骨髓水肿; 然而,这被认为是由于活检证实的骨转移。
磁共振成像也有助于识别滑膜积液。
杵状指可以在MR成像中表现为甲床和指甲根部下方的软组织增厚,具有弥漫性对比增强和水肿,表明甲床中的血管过多。
四肢的厚皮动脉硬化症和继发性HOA的MR成像结果可以是难以区分的。Cutis verticis gyrata可以在颅骨的MR成像中表现为与减少的内部脂肪信号强度和带有皱纹的头皮增厚相关的外交增厚。
3)骨扫描术
放射性核素骨扫描,通常使用锝99m(99m Tc) - 亚甲基二膦酸盐(MDP),对于检测和表征HOA的程度通常比单独使用放射线检查更敏感。事实上,HOA通常在患有已知恶性肿瘤的患者的骨扫描中偶然被诊断出来。
通常,沿着骨干的皮质边缘和长管状骨的干骺端以线性方式在骨膜上对称增加示踪剂摄取,称为电车线或双条纹标志。指/趾骨中突出的示踪剂摄取反映了杵状指。肢体中的单侧分布可指向继发于动脉移植物感染的局部HOA。除诊断外,放射性核素骨扫描也可用于评估治疗反应,因为闪烁扫描结果可在治疗潜在的继发性原因后解决。
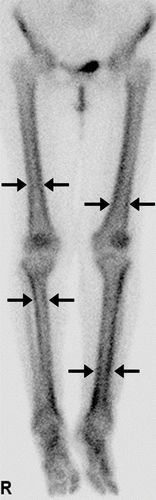
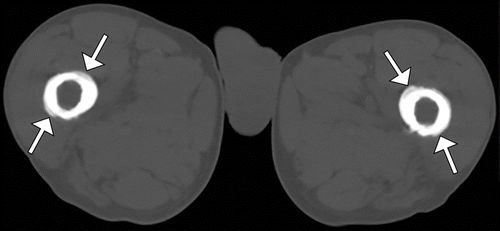

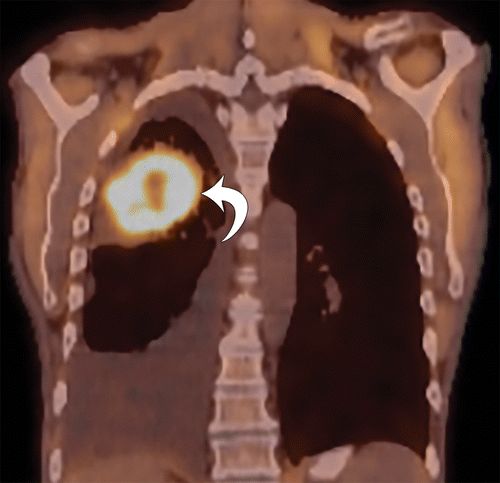
图11.一名60岁男性患有继发性HOA,肺腺癌,分化差。(a)99m Tc-MDP骨扫描显示经典电车线或双条纹(箭头)。(b)轴向CT图像显示骨膜新骨形成(箭头)。(c)相应的PET图像显示氟化物18(18 F)-FDG摄取。(d)冠状熔融18 F-FDG PET / CT重建演示了主右上叶损伤(箭头),与次级一致HOA。
(六)HOA的鉴别诊断
几种也表现出多灶性骨膜反应的病症可以模拟HOA的放射学表现(表4)。尽管与患者的年龄和症状相关是有帮助的,但关注某些成像特征可以极大地帮助大家缩小多发性骨膜炎的鉴别诊断。这些特征包括骨膜反应的类型和解剖学分布,以及骨质破坏和软组织和骨髓异常的存在与否。
表4:多灶性骨膜反应的鉴别诊断
1)甲状腺Acropachy
甲状腺功能障碍通常在治疗Graves病后出现,包括甲状腺消融或切除术后。患者还会出现杵状指,胫前粘液性水肿和眼球突出症。甲状腺acropachy的骨膜反应通常是花边,蓬松,毛刺和厚,涉及手和脚短管状骨,通常涉及第一,第二和第五掌骨的径向侧,以及近端和中间的趾骨(图12)。与HOA不同,胫骨,腓骨,桡骨和尺骨通常不参与。下肢的MR成像可能显示与甲状腺皮肤病或粘液性水肿相关的变化:在堆积形态的基础上,可以识别由脂肪饱和的T2加权图像上的等信号和高信号的混合成分组成的皮下软组织肿块。
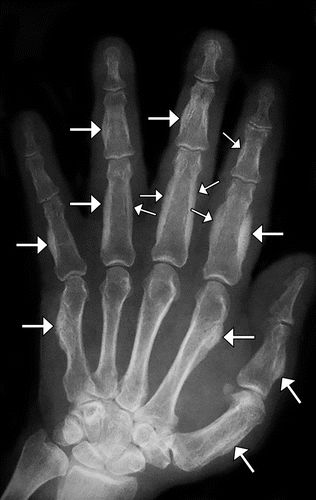
图12.一名45岁女性的甲状腺功能障碍。左侧的PA射线照片显示出蓬松、非线性,厚的骨膜炎(箭头),涉及第一,第二和第五掌骨以及所有中间和近端指骨的干骺端。
2)伏立康唑诱发的骨膜炎
伏立康唑是第二代三唑类抗真菌剂,通常用于治疗免疫功能低下(例如器官移植)患者的侵袭性曲霉菌病和念珠菌血症。患者通常出现难治性关节疼痛。由伏立康唑诱导的骨膜炎通常具有比HOA更曲折且更不对称的程度,并且可以影响锁骨,肋骨,肩胛骨,髋臼和手。骨膜反应呈现致密,局灶性,结节状和不规则(图13),与HOA中的平滑或线性骨膜炎相反。骨扫描的摄取增加对应于骨膜反应的区域,并且可能模拟弥漫性骨转移。伏立康唑的高氟化物成分可能与骨骼表现与氟中毒的相似性相关(62)。停药时通常会出现症状和骨膜炎(63)。
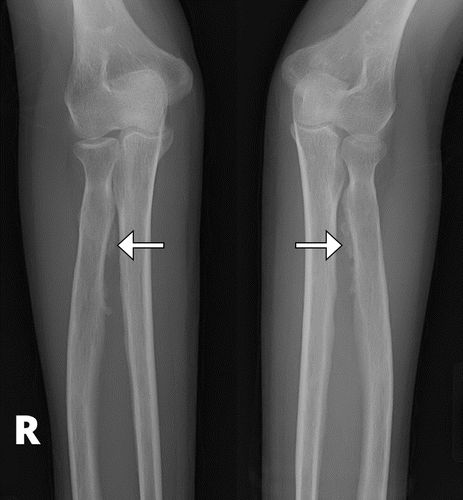
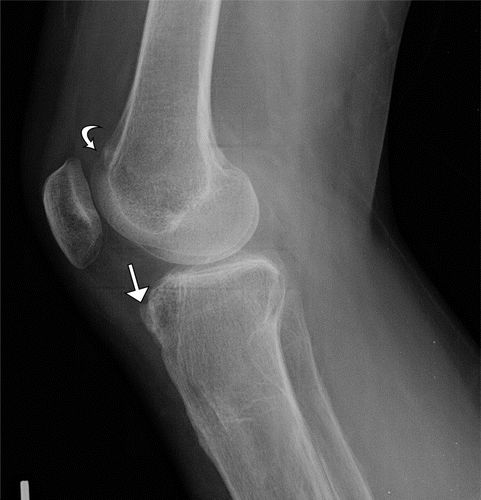
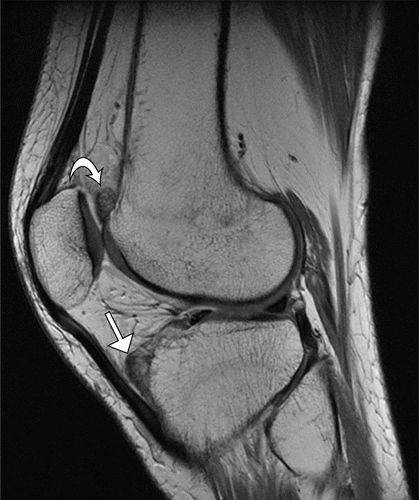
图13.伏立康唑诱发的骨膜炎。46岁女性患有囊性纤维化和双侧肺移植术后使用伏立康唑的长期病史,双侧肘部和左膝疼痛。(a,b)双侧前臂片(a)和左膝的侧位X线片(b)显示局灶性结节性骨膜炎,包括近端桡骨干(a)中的箭头,以及股骨远端(b中的弯曲箭头))和前胫骨近端(b中的直箭头)。(C)左膝的矢状质子密度加权MR图像显示股骨远端的低至中间信号强度的相应结节病灶,刚好(弯曲箭头)至股骨滑车,并且近端胫骨近端(直箭头)至胫骨结节。
4)白血病和淋巴瘤 Leukemia and Lymphoma
两个病都可以与侵袭性出现的骨膜反应相关联,所述骨膜反应在外观上通常是薄的或薄片化的。射线照片还可能显示长骨末端附近的渗透性溶解病变和大于骨破坏区域的软组织肿块,尽管这些发现可能是细小的或不明显的,特别是考虑到受累程度,并且可能很少或没有皮质破坏。MR成像可以明确显示肿瘤所涉及的任何相关骨髓和软组织异常(图15)。在霍奇金淋巴瘤中可以看到更突出的骨破坏。
5)维生素A过多症 Hypervitaminosis A
这通常源于青春期和青春期前患有痤疮,牛皮癣或烧伤的儿童类维生素A的过量使用。厚的,密集的,波状的骨膜反应通常在骨干附近最大,并且朝向骨的末端逐渐变细(图16)。长骨,如尺骨和跖骨,其次是锁骨,胫骨和腓骨,是最常见的部位。也可能发生管状骨的皮质增厚。射线照片还可能显示拔除或张开的干骺端和过早或不对称的物理闭合,导致锥形骺的出现。维生素A过多症也可能导致肌腱和韧带钙化,包括前颈椎骨质增生,这可能模仿弥漫性特发性骨骼骨肥厚,并可能是这些患者颈部僵硬和吞咽困难的原因。
|
|
6)进行性干骺端发育不良 Progressive Diaphyseal Dysplasia
进行性干骺端发育不良(Camurati-Engelmann病)是一种罕见的常染色体显性疾病,其特征是双侧对称性皮质增厚(图17)。由于骨内膜以及骨膜新骨形成,长骨的骨干扩大。骨内皮质增厚的存在是与HOA的重要区别特征,其仅具有骨膜新骨形成。通常不涉及干骺端和骨骺,因为这些区域是由软骨内骨化形成的。颅底硬化可导致颅神经受压,导致感觉缺陷,失明或耳聋。骨显像可能显示原发性骨干发育不良中整个增厚皮质的摄取增加,而不仅仅是HOA中的骨膜分布。
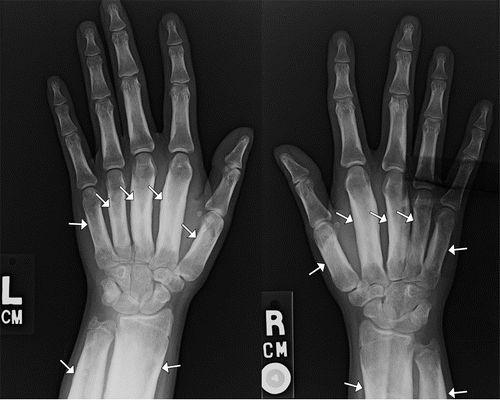
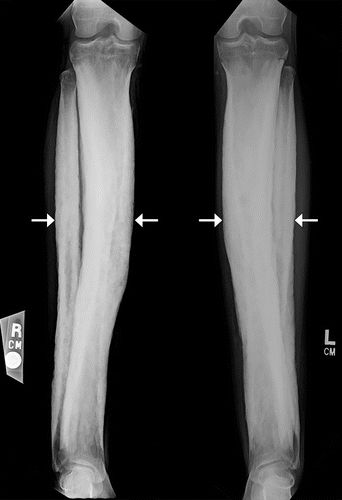
图17.一名18岁女性患有头痛和骨痛的进行性干骺端发育不良。
(七)HOA的预后和治疗
原发性HOA通常是自限性的,不会影响寿命。症状通常在30-40岁稳定甚至消退。然而,患者可能会出现明显的合并症,如骨髓纤维化,贫血和压迫性神经病变。
通常用镇痛药对症治疗原发性HOA。尽管PGE 2在HOA的发病机制和NSAIDs作为强效前列腺素抑制剂的功能中起着理论作用,但非甾体类抗炎药(NSAIDs)并不会诱导骨骼综合征消退。
伴有厚皮病的患者也可咨询整形外科医生以去除多余的皮肤或给予A型肉毒杆菌毒素用于美容目的。
继发性HOA的预后和死亡率与潜在的疾病本身有关。继发性HOA患者恶性肿瘤的高患病率(高达90%)加剧了这一事实的重要性。因此,明确的临床管理针对根本原因的治愈性治疗,包括手术选择,包括肺肿瘤切除,肺移植和紫绀型心脏病的矫正,旨在明确治疗潜在的主要原因。在对潜在原因进行手术矫正后,与继发性HOA相关的症状和影像学异常可能会消失。
例如,在一例病例中,肺癌切除术后下肢骨膜缩小及其相应的闪烁变化得以解决。
继发于血管移植物感染的HOA通过手术切除感染的假体和静脉内抗生素治疗来治疗。据报道,血管移植物感染的预后较差,总生存率仅为58%,治疗后并发症发生率为57%。
作为VEGF抑制剂起作用,双膦酸盐和八嗪也被报道为继发性HOA中的骨痛提供有效的对症治疗。或者,迷走神经切断的迷走神经切断术可以为难治性病例提供缓解症状的疼痛。
来源:医疗互动,仅用于学习交流,未经授权禁止转载!