

三阴性乳腺癌(triple negative breast cancer,TNBC)主要是指雌激素受体、孕激素受体表达阴性,缺乏人HER2过表达或基因扩增的乳腺癌,占全部乳腺癌的15%~20%,TNBC组织学分级高,侵袭力强,进展快,易远处转移,不能从内分泌治疗及抗HER2治疗中获益,因此晚期TNBC预后差,中位OS只有8~13个月[1],研究表明,与非TNBC相比,TNBC的组织标本中肿瘤浸润淋巴细胞(tumor infitrating lymphocytes,TILs)[2]和PD-L1蛋白、mRNA[3]均高表达,且PD-LI表达与TILS存在相关性[4],因此,TNBC可能是1CIs治疗的潜在受益人群。
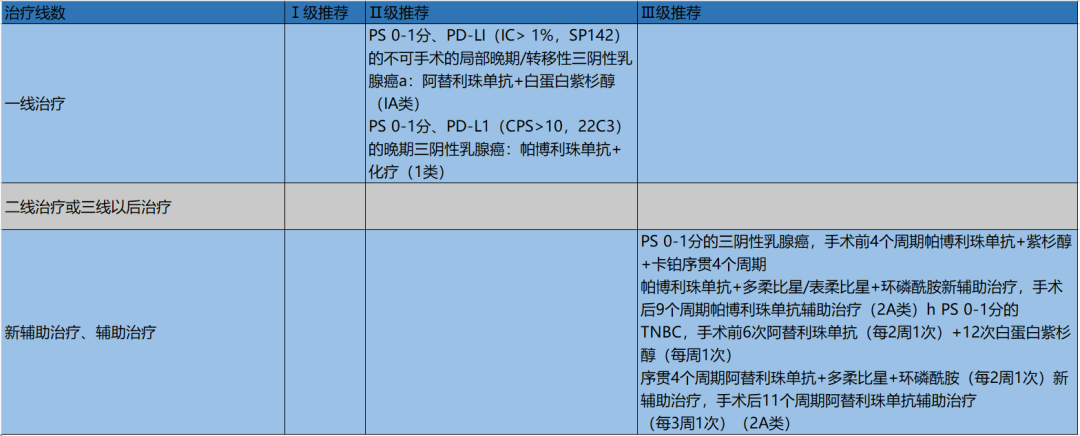
Ⅲ期IMpassion130研究显示,902名不可手术的局部晚期/转移性TNBC初治患者按1:1比例随机分配到试验组或对照组,试验组为阿替利珠单抗+白蛋白紫杉醇,对照组为安慰剂+白蛋白紫杉醇。阿替利珠单抗联合白蛋白紫杉醇组中位PFS为7.2个月,对照组5.5个月(HR 0.80,95%C1 0.69-0.92;P=0.0025),阿替利珠单抗+白蛋白紫杉醇组中位OS为21.0个月,对照组为18.7个月(HR 0.87;95%CI 0.75~1.02;P=0.077)。
PD-L1阳性患者阿替利珠单抗+白蛋白紫杉醇组中位PFS为7.5个月,对照组为5.0月(HR 0.62;95%C10.49~0.78;P<0.0001),PD-LI阳性患者阿替利珠单抗+白蛋白紫杉醇组中位OS为25.4个月,对照组为17.9个月(HR 0.67;95%C1 0.53~0.86)。
该研究已经得到FDA批准并进入美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南作为Ⅰ类推荐,虽然尚未获得NMPA批准,鉴于阿替利珠单抗在中国已获得广泛期SCLC和晚期肝细胞癌(hepatocellular cacinma Hc)等适应证,因此本指南将其作为Ⅱ级推荐1类证据。其中PD-LI阳性定义为肿瘤浸润免疫细胞PD-L1 1%(SP142)[5],虽然随后的IMpassion研究用紫杉醇替换白蛋白紫杉醇,得出了与Massion130研究相反的结论,但本指南仍然建议循NCCN指南。
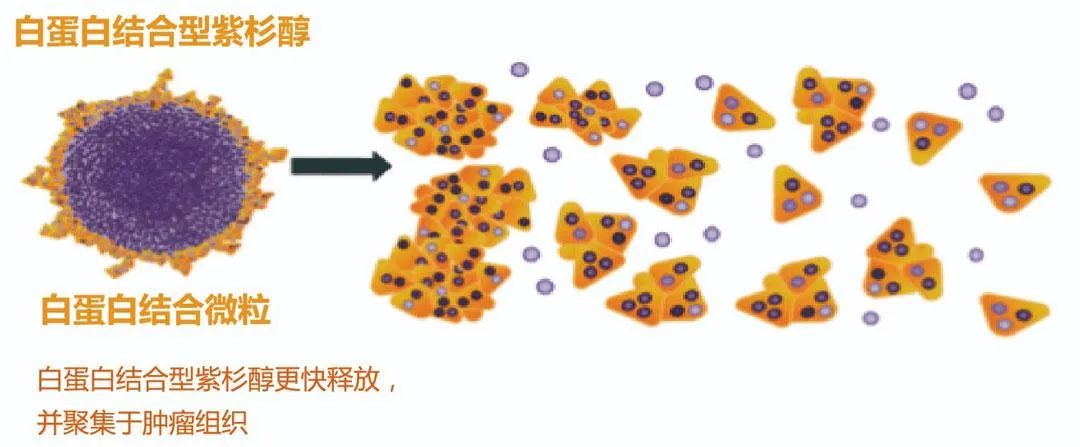
Ⅲ期KEYNOTE-355研究对847例复发或者转移性TNBC初治患者按2:1给予帕博利珠单抗+化疗或者安慰剂+化疗(化疗方案包括白蛋白紫杉醇、紫杉醇或吉西他滨+卡铂)治疗[6],结果显示,PD-L1 CPS ≥10患者,帕博利珠单抗+化疗组PFS为9.7个月,安慰剂+化疗组为5.6个月(HR 0,65,95%CI 0.49~0.86,P=0.0012);PD-LI CPS ≥1患者,帕博利珠单抗+化疗组PFS为7.6个月,安慰剂+化疗组为5.6个月(HR 0.74,95%CI 0.61~0.90,P=0.0014);ITT患者帕博利珠单抗+化疗组PFS为7.5个月,安慰剂+化疗组为5.6个月(HR 0.82,95%CI0.69~0.97);OS尚未成熟;≥3级TRAE:帕博利珠单抗+化疗组为68%,安慰剂+化疗组为67%。
该研究已经得到FDA批准并进入NCCN指南作为Ⅰ类推荐,虽然尚未获得NMPA批准,但鉴于帕博利珠单抗在中国已获得晚期NSCLC一线治疗等适应证,因此本指南将其作为Ⅱ级推荐1类证据。
2019 年ESMO年会报道的Ⅱ期KATE2研究显示,既往接受紫杉醇和曲妥珠单抗治疗失败的HER2阳性晚期乳腺癌患,试验组给予T-DMI+阿替利珠单抗,对照组给予T-DMI+安慰剂,结果显示,试验组中位PFS为8.2个月,对照组的中位PFS为6.8个月(HR 0.82,95%CI0.55~1.23,P=0.333 2),两组无统计学差异。但是在PD-LI阳性亚组分析中,T-DMI+阿替利珠单抗组的中位PFS为8.6个月,对照组中位PFS为4.1个月(HR 0.60,95%C1 0.32~1.11)联合治疗显著延长患者PFS;实验组的1年0S率为94.3%,对照组的1年OS率为87.9%(HR0.55,95%C1 0.22~1.38)[7]。
在Ⅱ期TONIC研究中[8],67例转移性TNBC患者被分为5组:
(1)纳武利尤单抗治疗;
(2)放射(3x8Gy)诱导治疗后纳武利尤单抗治疗;
(3)环磷酰胺口服50mg qd ,连续2周,诱导治疗后纳武利尤单抗治疗;
(4)顺铂40mg/m2,1次/周,连续2周,诱导治疗后纳武利尤单抗治疗;
(5)多西他赛15mg,1次/周,连续2周,诱导治疗后用纳武利允单抗单药治疗。
所有患者ORR为20%,顺铂诱导组23%,多西他赛诱导组35%,研究整体ORR为66%(CR 3%,PR 17%),各治疗组OR分别为17%(无诱导),8%(放疗诱导)、8%(环磷酰胺诱导),23%(顺铂诱导)和 35%(多西他赛诱导),产生应答患者的一年OS率为85%,整体人群中位PFS为1.9个月,中位应答持续时间为9个月。诱导治疗相关不良事件发生率为28%(任意级别)和3%(3级),3~5级irAE发生率为19%。
在2018年ASCO报道Ⅱ期TOPACIO/KEYNOTE-162研究中[9],PARP抑制剂Niraparib联合帕博利珠单抗治疗最多接受过2线治疗的晚期或转移性TNBC患者(不包括辅助或新辅助治疗),ORR为21%,DCR为49%,其中CR 5例(10.7%),PR 5例(12%),SD 13例(27.7%),PD23例(51%),其中有15例可评估患者BRCA基因突变,ORR为47%,DCR为80%,中位PFS为8.3个月。有27例可评估患者BRCA基因为野生型,ORR为11%,DCR为33%,中位PPS为2.1个月。
在1b-Ⅱ期PANACEA/KEYNOTE-014研究中,对HER2阳性、既往接受过曲妥珠单抗、触球单抗、TDM-1等抗HER2治疗耐药的转移性乳腺癌患者,给予帕博利珠单抗+曲妥珠的治疗,在PD-L1阳性患者中达到了主要终点(ORR为15%,DCR为25%),在PD-LI阴性患者中没有观察到患者缓解。OS尚未成熟。3~5级TRAE发生率为29%[10]
在2019年ESMO报道Ⅲ期KEYNOTE-522研究中[11],1174例TNBC患者按2:1比例入组,实验组手术前给予4个周期紫杉醇+卡铂+帕博利珠单抗序贯4个周期多柔比星/表柔比星+环磷酰胺+帕博利珠单抗新辅助治疗,手术后给予9个周期帕博利珠单抗辅助治疗,对照组手术前给予4个周期紫杉醇+卡铂+安慰剂序贯4个周期多柔比星/表柔比星+环磷酰胺+安慰剂,手术后给予9个周期安慰剂辅助治疗,主要终点是pCR和无事件生存(event-fee survival,EFS),分析帕博利珠单抗联合化疗组pCR率为64.8%,对照组为51.2%(P=0.00055),其中PD-L1阳性患者PCR率提高14.0%(68.9%us 54.9%),PD-L1阴性患者pCR率提高18.3%(45.3%vs 30.3%),IA2分析18个月EFS实验组为91.3%,对照组为85.3%,3~5级AE发生率实验组为76.8%,对照组为72.2%,该研究尚未进入NCCN指南,尚未获得FDA和NMPA批准,因此本指南将其作为Ⅲ级推荐2A类证据。
在Ⅲ期IMpassion031临床研究中,333例TNBC患者按1:1比例入组,试验组手术前给予6个周期阿替利珠单抗840mg(每2周1次)+12个周期白蛋白紫杉醇125mg/m2(每周1次),序贯4个周期阿替利珠单抗840mg+多柔比星(60mg/m2)+环磷酰(600mg/m2)(每2周1次)新辅助治疗,手术后给予11个周期阿替利珠单抗1200mg(每3周1次)辅助治疗,对照组给予6个周期安慰剂(每2周1次)+12个周期白蛋白紫杉醇125mg/m2(每周1次),序贯4个周期安慰剂+多柔比星(60mg/m2)+环磷酰胺(600mg/m2)(每2周1次)新辅助治疗,手术后观察至1年。
主要终点是ITT或PD-L1阳性(IC=1%)患者的pCR。ITT中的阿替利珠单抗+化疗组pCR为57.6%,安慰剂+化疗组为41.1%,PD-L1阳性患者阿替利珠单抗+化疗组PCR为68.8%,安慰剂+化疗组为49.3%,PD-LI阴性患者阿替利珠单抗+化疗组pCR为47.7%,安慰剂+化疗组为34.4%,阿替利珠单抗+化疗组≥3级TRAE为63%,安慰剂+化疗组为60%[12],该研究尚未进入NCCN指南,尚未获得FDA和NMPA批准,因此本指南将其作为Ⅲ级推荐2A类证据。
-----------END--------------

主要文献:
[1] DEN BROK WD, SPEERS CH, GONDARA L, et al. Survival with metastatic breast cancer based on initial presentation, de novo versus relapsed. Breast Cancer Res Treat, 2017, 161 (3): 549-556.
[2] LOI S. SIRTAINE N, PIETTE F, et al. Prognostic and predictive value of tumor-infilrating lympho-cytes in a phase Ill randomized adjuvant breast cancer trial in node-positive breast cancer comparing the addition of docetaxel to doxorubicin with doxorubicin-based chemotherapy: BIG 02-98. J Clin Oncol, 2013, 31 (7): 860-867.
[3] SABATIER R, FINETTI P, CERVERA N, et al. A gene expression signature identifies two prognos subgroups of basal breast cancer. Breast Cancer Res Treat, 2011, 126 (2): 407-420.
[4] ALI HR, GLONT SE, BLOWS FM, et al. PD-LI protein expression in breast cancer is rare, entiche in basal-like tumours and associated with infiltrating lymphocytes. Ann Oncol, 2015, 26 (7): 1481493.
[5] SCHMID P, ADAMS S, RUGO HS, et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. N Engl J Med, 2018, 379 (22): 2108-2121.
声明:本文由好医术肿瘤学院作者整理,如有侵权请联系删除,转载需授权。













