
免疫治疗实体瘤疗效评价标准(immunotherapy response evaluation criteria in solid tumors,iRECIST)是在irRC,irRECIST和imRECIST基础上发展的免疫治疗疗效评价标准。

免疫治疗实体瘤疗效评价标准


测量方法

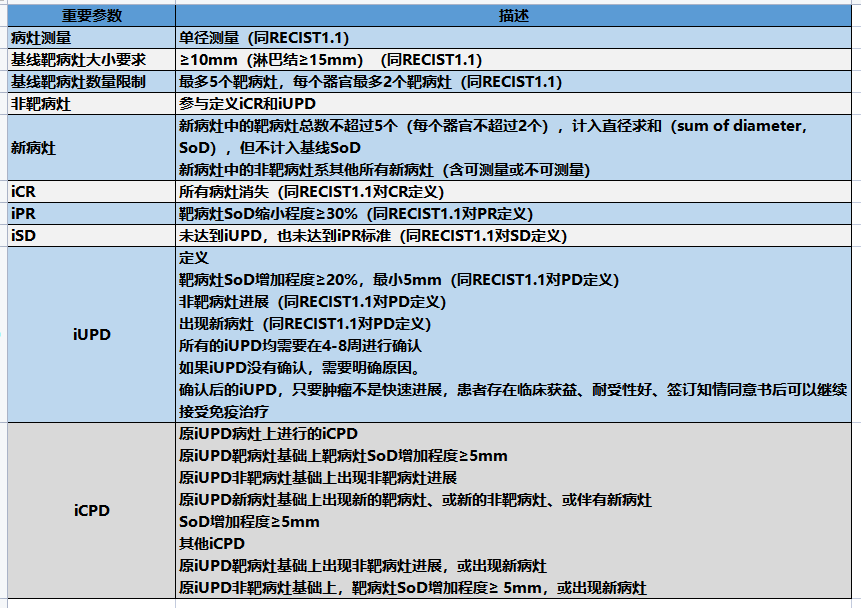
病灶测量:临床评价时,所有肿瘤测量都要以公制米制记录。所有关于肿瘤病灶大小的基线评定都应尽量在接近治疗开始前完成,且必须在治疗开始前的28天内(4周)完成。
评价方法:对病灶基线评估和后续测量应采用同样的技术和方法。除了不能用影像学检查,而仅能用临床检查来评价的病灶之外,所有病灶必须使用影像学检查进行评价。
临床病灶:临床病灶只有位于浅表且测量时直径≥10mm时才能认为是可测量病灶(如皮肤结节等)。对于有皮肤病灶的患者,建议用含有标尺测量病灶大小的彩色照片作为存档。当病灶同时使用影像学和临床检查评价时,由于影像学更客观且研究结束时可重复审阅,应尽可能选用影像学评价。
胸部X片:当肿瘤进展作为重要研究终点时,应优先使用胸部CT,因为CT比x线更敏感,尤其对于新发病灶。胸部X片检测仅当被测量病灶边界清晰且肺部通气良好时适用。
CT,MRI:CT是目前用于疗效评价最好的可用可重复的方法。本指导原则对可测量性的定义建立在CT扫描层厚<5mm的基础上。如果CT层厚大于5mm,可测量病灶最小应为层厚的2倍。MRI在部分情况下也可接受(如全身扫描)。
超声:超声不应作为一种测量方法用于测量病灶大小。超声检查因其操作依赖性,在测量结束后不具备可重复性,不能保证不同测量间技术和测量的同一性。
如果在试验期间使用超声发现新病灶,应使用CT或者MRI进行确认。如果考虑到CT的放射线暴露,可以使用MRI代替。
内窥镜,腹腔镜检查:不建议使用这些技术用于肿瘤客观评价,但这种方法在取得的活检标本时可以用于确认CR,也可在研究终点为CR后复发或手术切除的试验中,用于确认复发。
肿瘤标志物:肿瘤标志物不能单独用来评价肿瘤客观缓解。但如果标志物水平在基线时超过正常值上限,用于评价完全缓解时必须回到正常水平。因为肿瘤标志物因病而异,在将测量标准写入方案中时需考虑到这个因素。
有关CA-125缓解(复发性卵巢癌)及PSA(复发性前列腺癌)缓解的特定标准已经发表。且国际妇科癌症组织已制定了CA-125进展标准,即将被加入到卵巢癌一线治疗方案的肿瘤客观评价标准中。
细胞学/组织学技术:在方案规定的特定情况下,这些技术可用于鉴定PR和CR(如生殖细胞肿瘤的病灶中常存在残留的良性肿瘤组织)。当渗出可能是某种疗法潜在的副反应(如使用紫杉烷化合物或血管生成抑制剂的治疗),且可测量肿瘤符合缓解或疾病稳定标准时,在治疗过程中肿瘤相关的渗出出现或加重,可通过细胞学技术来确诊,以区分缓解(或疾病稳定)和疾病进展。

靶病灶和非靶病灶的基线记录

基线评估时有超过一个以上可测量病灶时,应记录并测量所有病灶,总数不超过5个(每个器官不超过2个),作为靶病灶代表所有累及器官(也就是说只有一个或两个累计器官的患者最多选择两个或四个靶病灶作为基线测量病灶),靶病灶必须基于尺寸进行选择(最长直径),能代表所有累及器官,且测量必须具有良好的重复性。有时候当最大的病灶不能重复测量时可重新选择一个可重复测量的最大病灶。
淋巴结因其为正常组织且即使没有肿瘤转移仍可为影像察觉而需要特别关注。定义为可测量结节甚至是靶病灶的病理性淋巴结必须符合以下标准:CT测量短直径≥15mm。基线只需要检测短直径。放射学家通常借助结节的短直径来判断该结节是否已有肿瘤转移。结节尺寸一般用影像检测的两维数据来表示(CT用轴平面,MRI则从轴面、矢状面或冠状面中选择一个平面)。取最小值即为短直径。例如,一个20 mm× 30 mm的腹部结节短直径为20 mm,可视为恶性的、可测量的结节。在这个例子中,20mm即是结节的测量值。直径≥10 mm但<15mm的结节不应该视为靶病灶。而<10mm的结节则不属于病理结节范畴,不必予以记录和进一步观察。
所有靶病灶的直径经过计算所求之和(包括非结节病灶的最长直径和结节病灶的短直径)将作为基线直径总和上报。如含有淋巴结直径,如上面提到的,只将短直径计算在内。基线直径总和将作为疾病基线水平的参考数值。
其余所有的病灶包括病理淋巴结可视为非靶病灶,无需进行测量,但应在基线评估时进行记录。如记录为“存在”,“缺失”或极少数情况下"E确进展"。广泛存在的靶病灶可与靶器官记录在一起(如大量扩增骨盆淋巴结或大规模肝转移)。

缓解标准

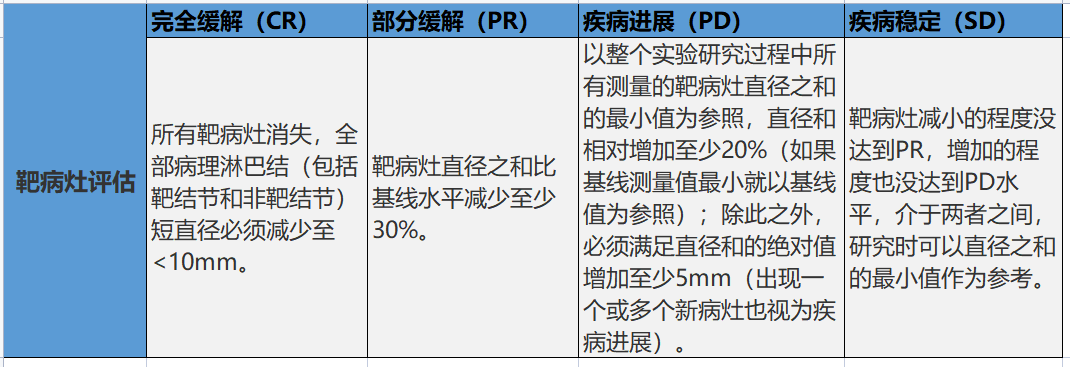
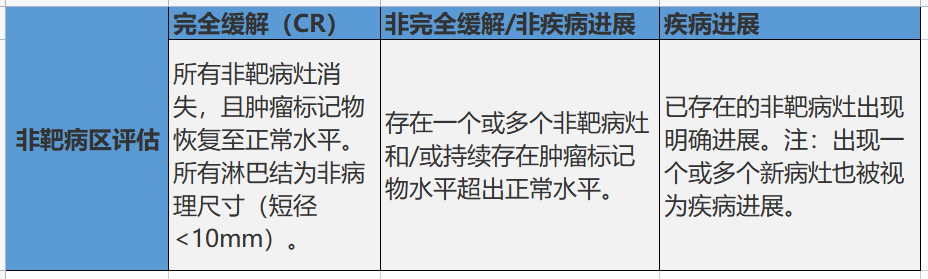
iRECIST只是一个国际上认可的疗效评价标准共识,还不能替代RECISTI.1来评价真实世界中免疫治疗的疗效。一般地,在晚期临床试验中,RECIST1.1仍然作为主要评价标准,用以获取主要研究终点,包括ORR,PFS,而iRECIST是探索性评价标准;在早期临床试验中,iRECIST可作为主要评价标准。
如果确认了免疫确认的进展(immune confirmed progression,iCPD),患者出现PD的时间是在初次评价免疫未确认的进展(immune unconfirmed progression,iUPD)时的时间。
对于疑似快速进展的患者,如果免疫治疗是一线治疗,评价iUPD后需要4周后确认[肿瘤生长速度(tumor growth rate,TGR)大于以前];如果是二线治疗,因评价iUPD时即可识别超进展(TGR大于以前),因此常不需要再确认。
参加临床试验的患者,如果没有确认iUPD,需要明确原因。
iRECIST可作为免疫治疗临床应用决策的参考,确认后的iUPD患者需要综合临床表现来决定是否继续使用免疫治疗。部分患者可能经过多次iCPD后仍可从免疫治疗中获益。
-----------END--------------
参考文献(滑动查看)
[1] SEYMOUR L, BOOAERIS J, PERRONE A, et al. iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics, Lancet Oncol, 2017, 18 (3): e143-e152.
[2] WOLCHOK JD, HOOS A, O' DAY S. et al. Guidelines for the evaluation of immune therapy acivity in solid tumors: immune-related response criteria. Clin Cancer Res, 2009, 15 (23): 7412-7420.
[3] NISHINO M, GIOBBIE-HURDER A, GARGANO M, et al. Developing a common language for tumor response to immunotherapy: immune-related response criteria using unidimensional measure ments. Clin Cancer Res, 2013, 19 (14): 3936-3943.
[4] HODI FS, BALLINGER M, LYONS B, et al. Immune-modified response evaluation criteria in solid tumors (imrecist): refining guidelines to assess the clinical beneft of cancer immunotherapy. J Clin Oncol, 2018, 36 (9): 850-858.
[5] BORCOMAN E, KANJANAPAN Y, CHAMPIAT S, et al. Novel patterns of response under immuno-therapy. Ann Oncol, 2019, 30 (3): 385-396.
[6] CHAMPIAT S, FERRARA R, MASSARD C, et al. Hyperprogressive disease: recognizing a novel pa-temn to improve patient management. Nat Rev Clin Oncol, 2018, 15 (12): 748-762.
声明:本文由好医术肿瘤学院作者编辑,部分源于网络,仅供学习交流,如有侵权请联系删除,转载需授权。














