
近日,美国约翰霍普金斯大学医学院、范德比尔特大学医学中心以及纪念斯隆凯特琳癌症中心等机构的研究团队合作在Cancer research上发表了题为“Genomic Landscapes and Hallmarks of Mutant RAS in Human Cancers ”的文章。为了更好地了解体细胞RAS突变的患病率和RAS突变肿瘤中共突变的基因概要,研究团队分析了美国癌症研究协会(AACR)项目GENIE中涉及51种癌症类型的66,372个肿瘤607,863个突变的靶向NGS序列数据,估计了RAS和非RAS体细胞突变癌症特异性患病率,揭示了肿瘤突变负荷和突变特征对共突变模式的影响。该研究结果突出了RAS基因组的多样性,为开发有效的组织特异性靶向治疗策略提供了信息。

研究团队分析了AACR项目GENIE Registry 6.1版的靶向NGS数据,包含来自51种癌症类型和19个研究中心的66,372名个体的607,863个突变。研究人员使用贝叶斯层次模型估计了队列中KRAS、NRAS和HRAS等位基因突变在密码子12、13和61处的癌症特异性患病率,并按年龄、种族和性别进行分层。(图1)
结果显示,RAS密码子12、13和61突变的后验中位患病率在不同癌症类型中差异较大:胰腺癌(PAC)为74.0%、结直肠癌(CRC)43.5%、非小细胞肺癌(NSCLC)为29.7%,黑色素瘤为25.3%、原发不明癌(CUP)为20.9%。RAS突变在前列腺癌、乳腺癌、肾癌和间皮瘤中不太常见,突变率约为1%。KRAS突变在胃肠道肿瘤、肺癌和妇科恶性肿瘤等癌症中发生频率较高;NRAS突变在黑色素瘤、甲状腺癌和血液系统恶性肿瘤中出现更频繁;HRAS总体的突变频率较低。
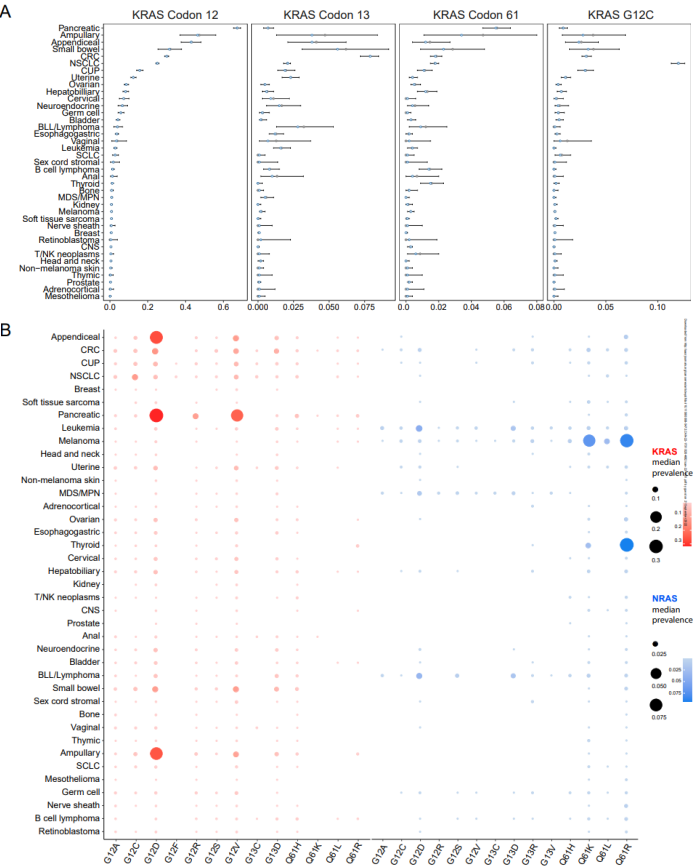
图1. KRAS、NRAS和HRAS突变等位基因在密码子12、13和61处的特异性流行率。
接下来,研究团队调整了患病率的分析方式,以研究RAS等位基因突变在年龄、性别和种族方面的分布差异(图2)。结果显示,RAS突变在年轻黑色素瘤、CUP、NSCLC和PAC患者中较低,其在较年轻的卵巢癌、b淋巴母细胞白血病/淋巴瘤患者中更普遍。研究团队也在RAS突变中发现了基于性别的差异。与男性相比,女性的CRC和NSCLC肿瘤携带RAS突变频率更高,但其黑色素瘤中的RAS突变较少。
同时,研究团队评估了RAS等位基因突变在不同种族背景下的分布。与其他种族相比,黑人CRC患者肿瘤中RAS突变富集,且KRAS密码子12突变患病率较高。在NSCLC中,亚洲患者RAS突变患病率较低,KRAS密码子12突变患病率也较低。在黑色素瘤中,黑人和亚洲患者的NRAS Q61L突变患病率都较低。上述结果表明,RAS等位基因突变存在种族依赖性分布,因此在目标人群的选择和临床试验的合理设计中应加以考虑。
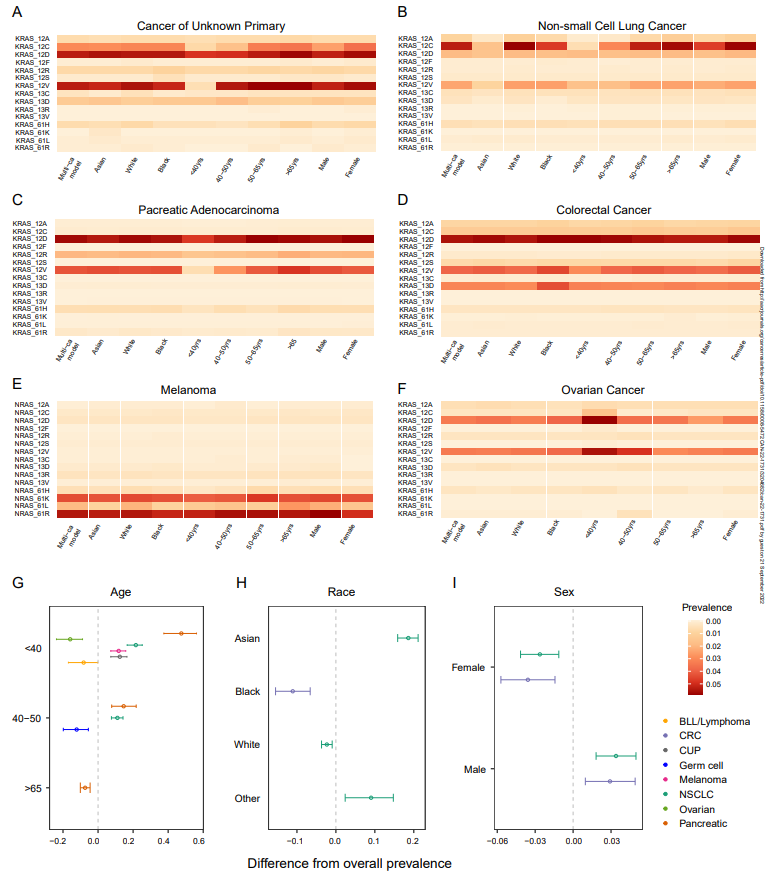
图2. RAS等位基因突变在年龄、性别和种族方面的分布差异。
为评估RAS共突变的基因概要,研究团队使用贝叶斯模型对RAS和非RAS基因之间的依赖性关系进行了跨癌症类型分层建模(图3)。分析结果显示,RAS和非RAS突变以一种癌症类型依赖的方式共同发生和相互排斥。RAS热点突变与NSCLC中的ATM、KEAP1、MAX、NKX2-1、RBM10、STK11和U2AF1突变,PAC中的CDKN2A突变,CRC中的PIK3CA突变等同时发生;与CRC中的BRAF和RNF43突变、NSCLC中的EGFR突变、PAC中的DAXX和MEN1相互排斥。多数RAS共突变模式是由KRAS驱动的。
图3. RAS和非RAS突变之间的共同发生和相互排斥关系。
鉴于不同年龄、性别和种族的RAS等位基因突变的患病率存在差异,研究团队认为共突变模式可能在患者亚人群中也存在差异分布,并通过分层分析探讨了这一假设(图4)。结果显示,与男性患者相比,患有KRAS G12D突变CRC肿瘤的女性患者更不可能携带RNF43突变,患有KRAS G13D突变CRC肿瘤的男性比女性更可能携带CASP8突变。亚洲CRC患者的KRAS G12V突变较少与TP53突变同时发生。上述发现表明,人类癌症中RAS共突变模式呈谱系和背景特异性分布。
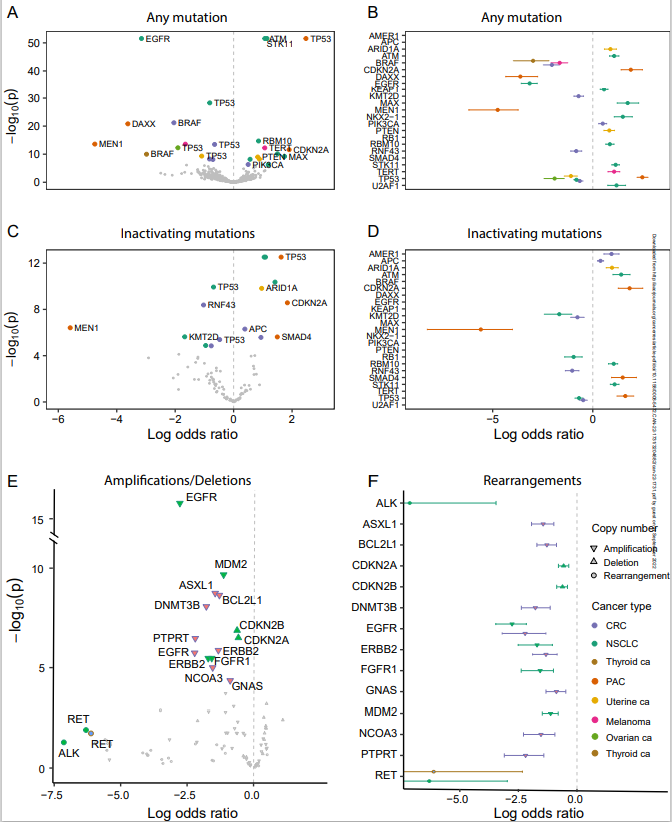
图4. RAS共突变模式在患者亚人群中的差异分布。
最后,研究团队探索了RAS突变肿瘤的特异性基因组轨迹与临床结果之间的关联。首先分析了来自癌症基因组图谱(TCGA)的10,217个肿瘤,并评估了携带RAS共突变的肿瘤个体的总体生存差异(图5)。与无KRAS共突变组相比,携带KRAS G12C与KEAP1、NTRK3、PIK3CA或TP53共突变的肺腺癌患者总生存期(OS)明显缩短;在RBM10和STK11突变存在的情况下,KRAS G12V突变会导致更差的患者预后。
在KRAS G12C共突变的肿瘤中,接受免疫疗法治疗的患者临床结果也存在显著差异。KRAS G12C/STK11共突变使NSCLC患者OS缩短,但携带KRAS G12C和TP53热点共突变的NSCLC患者获得了更长的OS。综上所述,该研究结果加深了对RAS突变癌症特征的见解,并将RAS基因组多样性与RAS突变的临床结果和治疗结合起来。
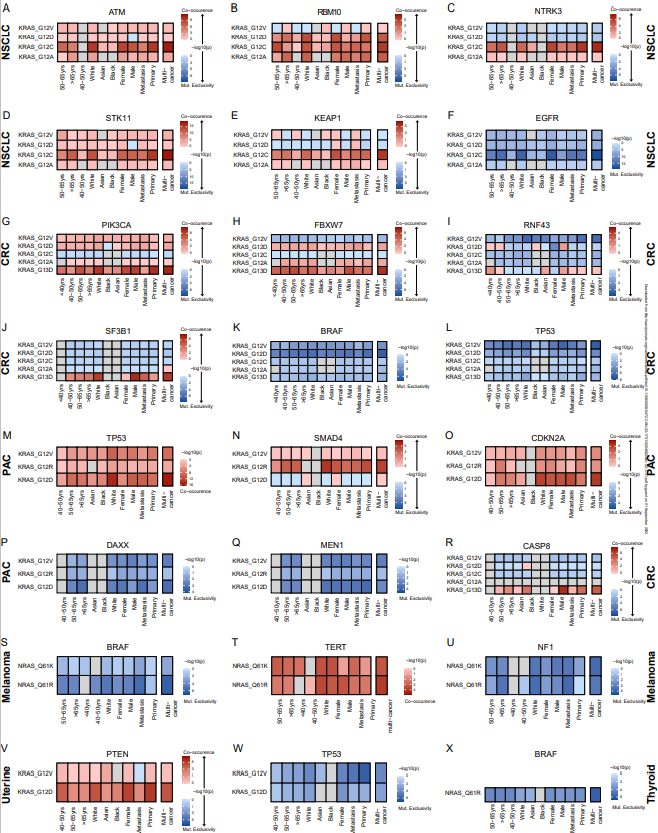
图5. RAS突变肿瘤的特异性基因组轨迹与患者生存期之间的关联。
综上所述,研究团队对RAS共突变的综合评估揭示了RAS突变肿瘤的背景依赖性基因组特征。研究结果表明,致癌RAS信号在不同的肿瘤类型中是不同的,RAS突变和共突变模式促成了不同的肿瘤表型,并可能指向不同的治疗缺陷和临床结果。
Robert B. Scharpf, Archana Balan, iagio Ricciuti, et al. Genomic Landscapes and Hallmarks of Mutant RAS in Human Cancers. Cancer Res CAN-22-1731. doi.org/10.1158/0008-5472.CAN-22-1731.
声明:本文来源测序中国,仅为交流学习。内容仅代表作者个人观点,望大家理性判断及应用。













