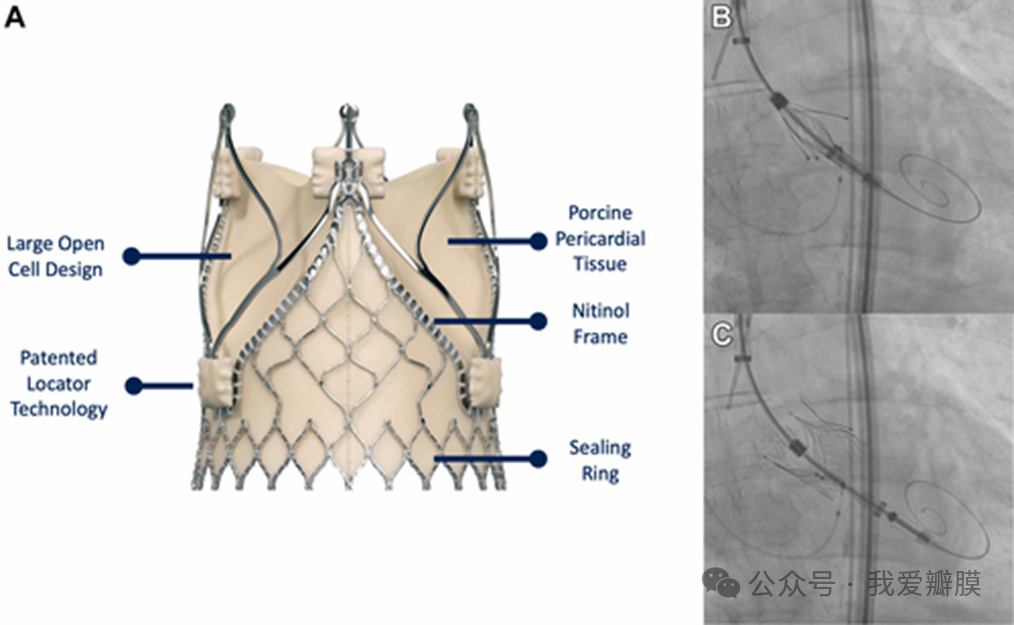
JenaValve Trilogy 系统可用于非钙化性纯主动脉瓣反流 (A)。使用经腔静脉通路,系统位于主动脉瓣上方 (B)。然后将其释放,使用专用定位机构 (C) 将其自身夹在阀门上。Jonathan Curio et al. J Am Coll Cardiol Case Rep 2024; 29
德国科隆大学医院的心脏病专家进行了首例经导管主动脉瓣置换术 (TAVR)手术,详细介绍了他们在 JACC 中的经验。
TAVR 患者是一名 65 岁男性,因射血分数保留的瓣膜性心力衰竭 (HFpEF) 导致反复出现心脏代偿失调、疲惫和呼吸困难的病史。使用超声心动图,护理团队确定严重的主动脉瓣反流(AR)是“唯一的瓣膜病变”。
该患者的病史还包括单支冠状动脉疾病、外周动脉疾病(PAD)、慢性阻塞性肺疾病、多次心力衰竭住院治疗和活动能力受损。他的外周动脉疾病之前曾接受过双髂支架植入术治疗。胸外科医生协会评分为5.32%。
考虑到这一长串先前的健康问题和合并症,护理团队确定手术不是一个现实的治疗选择。他们决定使用自膨胀式JenaValve Trilogy 心脏瓣膜系统进行 TAVR ,该系统于 2021 年在欧洲首次推出。作者解释说,JenaValve 装置包括一个镍钛诺支架框架,该支架带有定位器,有助于确保正确的连合和轴向对准。
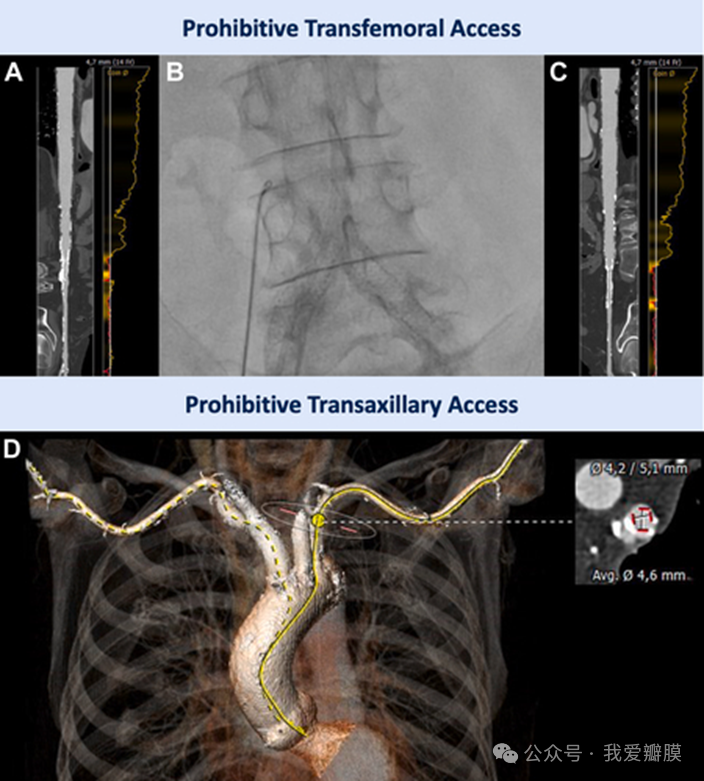
右(A)和左(C)髂动脉由于双髂支架 Y 型假体(B)而极度狭窄,禁止经股动脉进入。鉴于锁骨下动脉的轮廓较小,经腋窝入路也是不可行的 (D)。
在计划 TAVR 手术时,心脏病专家发现由于多种原因,他们的选择受到限制。
“计算机断层扫描血管造影显示经股动脉通路不可行,这主要是由于之前植入的双髂支架所致,”第一作者、科隆大学心脏病学系介入心脏病学家 Jonathan Curio 及其同事写道。“由于两侧血管直径太小(4.6 毫米)并且钙化,经腋窝入路被放弃。由于血管中度狭窄疾病可能增加中风风险,经颈动脉通路被认为不是最佳选择,因此经腔静脉通路是一个合理的选择。重要的是,对于新型自扩张可夹式装置的输送系统,必须仔细考虑替代途径,因为瓣膜是通过预成型且 85 厘米长的延长鞘植入的。预成型的远端鞘部分必须放置在窦管连接处 (STJ) 的正上方。”
库里奥等人。确定了右主动脉壁的无钙区域来规划他们的经腔入路。目标位置不靠近任何重要的动脉分支,并且鞘管的轨迹没有插入肠组织。
TAVR 手术需要“精确定位”引导导管,并且在导丝推进过程中,同轴交叉系统以 50 W 的功率通电。在推进导引鞘、穿过主动脉瓣并将 Safari 线放入左心室后,团队能够将带有负载 TAVR 瓣膜的输送系统移至 STJ。血管造影控制告诉团队瓣膜放置成功,没有瓣周渗漏的迹象。然后使用镍钛诺导管封堵器来封闭经腔静脉穿刺部位。
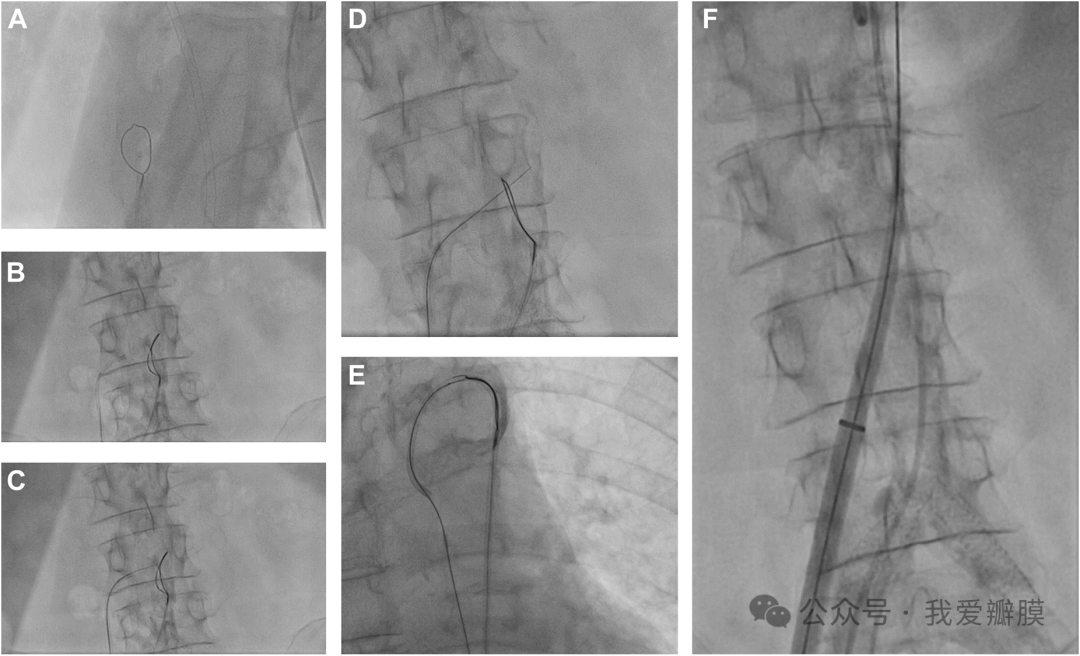
从腔静脉到腹主动脉的经腔交叉。环形圈套器位于主动脉中,交叉系统位于腔静脉中(A,B)。将电线推进至腹主动脉 (C),并在那里被套住 (D)。将圈套系统更换为坚硬的导丝,并使用已建立的经腔静脉通路(E,F)推进自扩张可夹式装置的输送系统。
作者写道:“本报告描述了第一个使用专用自扩张夹式装置经腔入路治疗纯 AR 的案例,取得了良好的中期结果。” “经腔静脉入路是最近推出的一种安全的替代入路选择,在主动脉瓣狭窄 TAVR 治疗中,与腋窝入路相比,中风、短暂性脑缺血发作的风险较低,且出血率相似。”
心脏病专家警告说,未来执行类似手术的护理团队可能会发现 TAVR 瓣膜的可操作性“受损”。此外,他们表示,与主动脉瓣狭窄患者相比,AR 患者往往“主动脉更加弯曲和扩张”。 手术后的另一个要点是,操作员需要进行多次更换,从较短的护套到设备的实际护套,然后再返回。“这可能意味着更高的出血和破裂风险,需要仔细评估,”作者写道。
三个月后,患者报告“症状明显缓解”,生活质量显着改善。CT 扫描证实主动脉腔静脉瘘完全闭合。
-END-
声明:本文转载于<我爱瓣膜>,仅用于学习交流,版权归原作者所有。如有侵权违规,请立即联系我们。













