心力衰竭是一种复杂的临床综合征,指心脏无法有效泵血以满足身体代谢需求,或心室充盈压力过高导致循环障碍。心衰的病因可分为原发性心肌损害和心脏负荷异常两大类
原发性心肌损害包括缺血性心脏病(如冠心病、心肌梗死导致心肌细胞坏死、纤维化,心脏收缩功能下降)、心肌病(扩张型心肌病、肥厚型心肌病、限制型心肌病等)、心肌炎(病毒、细菌感染或自身免疫反应引起心肌炎症)、心肌代谢异常(如糖尿病心肌病、甲状腺功能亢进 / 减退性心肌病、心肌淀粉样变性等)
心脏负荷异常包括压力负荷过重(后负荷,常见于高血压、主动脉瓣狭窄、肺动脉高压、肺动脉瓣狭窄等,心脏需克服更高压力泵血,导致心肌肥厚,最终失代偿。)、容量负荷过重(前负荷,见于心脏瓣膜关闭不全(如二尖瓣反流、主动脉瓣反流)、先天性心脏病(如室间隔缺损)、贫血、甲状腺功能亢进等,心脏长期过度充盈导致扩大和收缩功能下降。)、心律失常。
两类病因导致心脏结构和功能随时间逐渐恶化,逻辑是初始病因→心肌损伤 / 负荷增加→神经内分泌激活与心脏重构→代偿→失代偿→终末期
心衰器械治疗
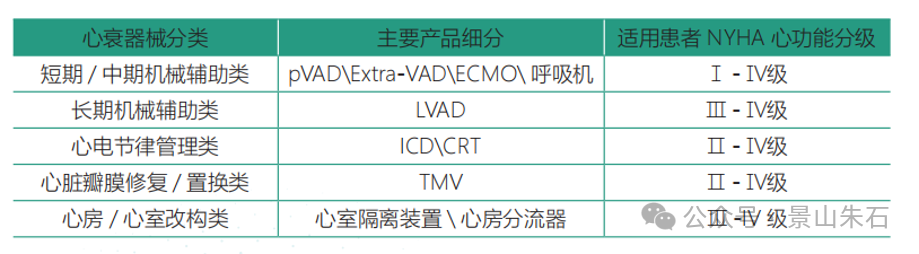
心脏的正常功能依赖于规律的心电节律使心肌规律收缩、正常搏动泵血。当心力衰竭发生时,心肌功能失调体现在三个方面:心脏结构(心肌与瓣膜)异常,心电活动紊乱,心肌收缩能力减弱(心脏的机械活动)导致泵血失能。
而心衰的器械治疗正是分别针对以上三方面进行纠正, 主要原理包括从解剖角度改善心脏物理结构、基于电相关技术进行心电节律管理或改善心肌收缩,通过机械性的支持改善心脏输出功能。与此同时,由于绝大多数的心力衰竭都是从左心衰竭开始的,首先表现为肺循环淤血,所以心衰患者也可能并发呼吸功能衰竭,机械性的支持同样也可以通过辅助心衰患者呼吸以达到缓解心衰症状的目的。
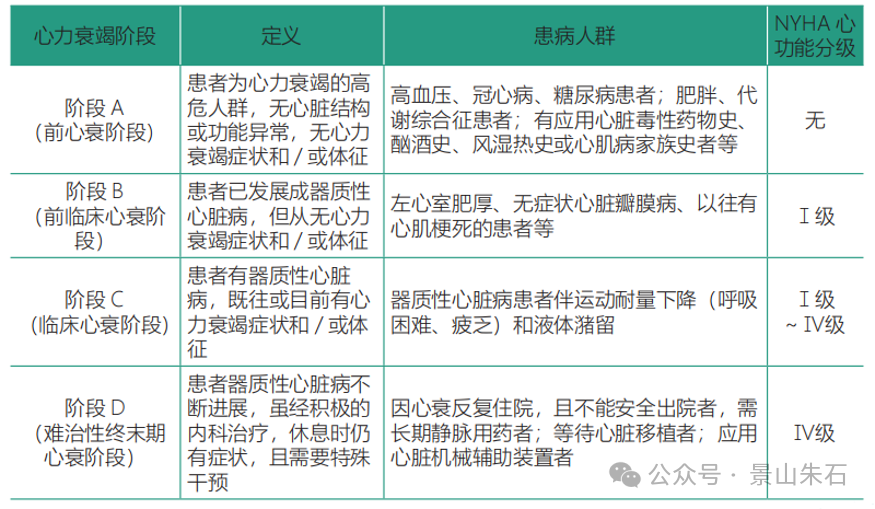
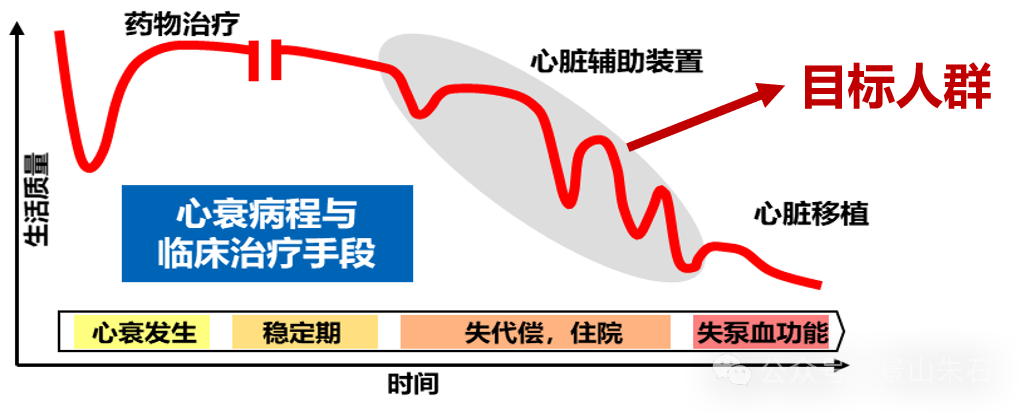
心力衰竭的疾病发展通常可以分为以下几个阶段(根据ACC/AHA心衰分期):
A期:有心衰高风险,但无结构性心脏病或症状。
B期:有结构性心脏病,但无心衰症状。
C期:有结构性心脏病,且有或曾有心衰症状。
D期:终末期心衰,症状严重,难治性。
在前中期的治疗中,药物治疗为主要治疗手段,介入治疗主要应用于C期和D期患者,但也有一部分针对B期患者的预防性干预。最后的解决方式就是心脏移植。
早期/中期心力衰竭(C期)的介入治疗
在这个阶段,患者通常已经接受了优化药物治疗,但可能仍有持续症状或存在心源性猝死风险。以下是这个阶段可以介入的一些主流器械,有一些在进展中可以和药物联用。
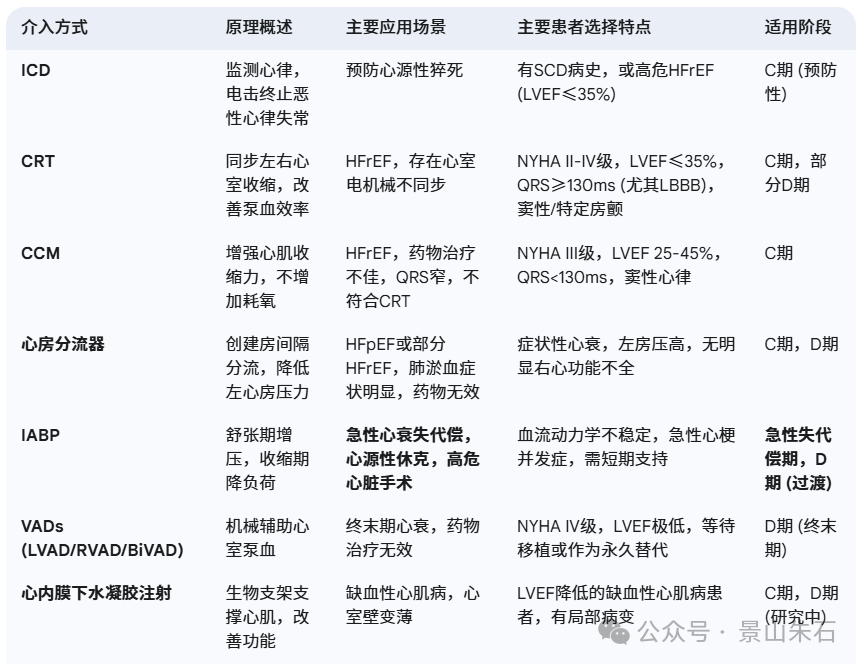
植入式心律转复除颤器 (ICD)
二级预防:已经发生过心脏骤停、室颤或血流动力学不稳定的室性心动过速,且非可逆性原因引起。
一级预防:针对有高危因素的患者。例如,缺血性或非缺血性心肌病,左心室射血分数 (LVEF) ≤35%,且NYHA心功能分级II-III级,经优化药物治疗后仍有症状。
原理:ICD是一种植入式设备,能持续监测心律。当检测到危及生命的快速室性心律失常(如室速、室颤)时,它能自动释放电击,终止恶性心律失常,从而预防心源性猝死 (SCD)。ICD也可以兼具起搏器功能。
应用场景与患者选择:ICD主要用于预防心力衰竭患者的心源性猝死,而不是直接治疗心衰症状。
适用阶段:适用于心衰的C期,特别是LVEF显著降低的患者,无论症状轻重,只要存在猝死高风险,都可能需要植入ICD。
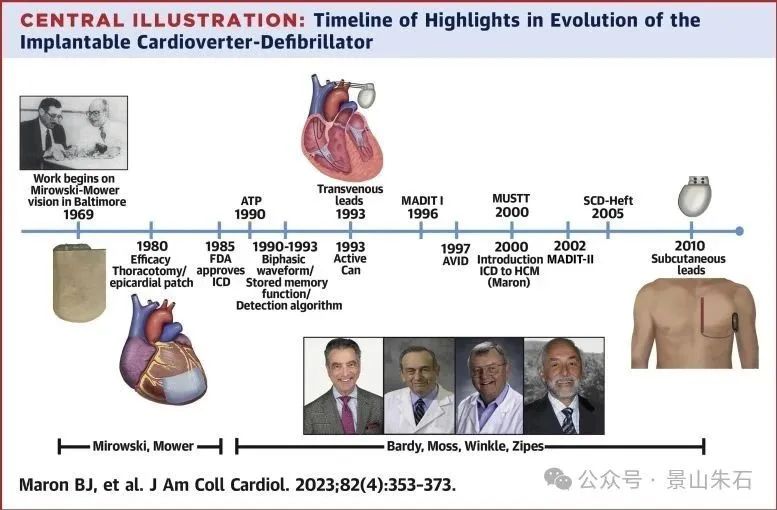
心脏再同步化治疗 (CRT)
原理:CRT通过在心腔内植入电极,对左右心室进行同步起搏,纠正心脏的电-机械不同步,从而改善心室收缩功能,提高泵血效率。
应用场景与患者选择:主要用于射血分数降低型心力衰竭 (HFrEF) 患者,且存在心室电机械不同步的证据。
NYHA心功能分级II-IV级。
左心室射血分数 (LVEF) ≤35%。
QRS波群宽度≥130毫秒 (ms),尤其是存在左束支传导阻滞 (LBBB) 的患者。 QRS波群越宽,LBBB越典型,CRT的获益越大。
窦性心律(或房颤患者,但需确保CRT起搏占比高)。
适用阶段:适用于心衰的C期和部分D期患者,在优化药物治疗后仍有症状并符合上述心电图标准。
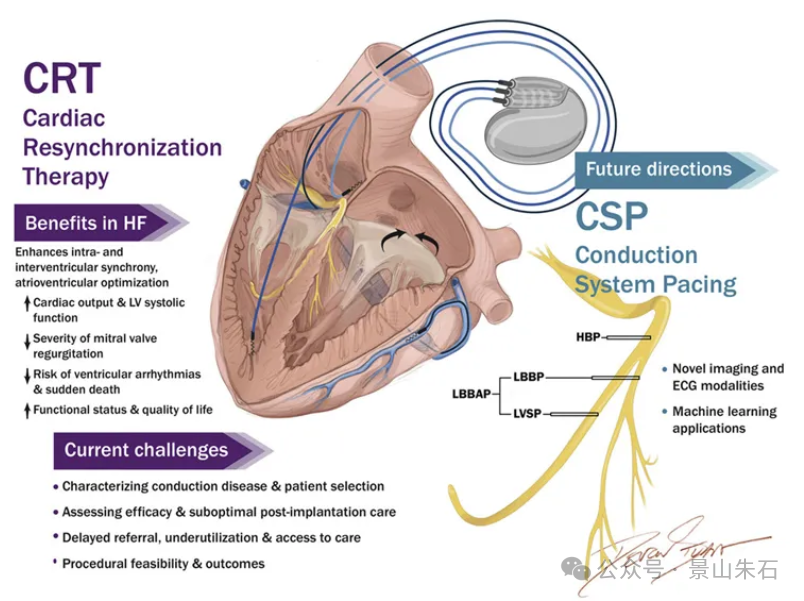
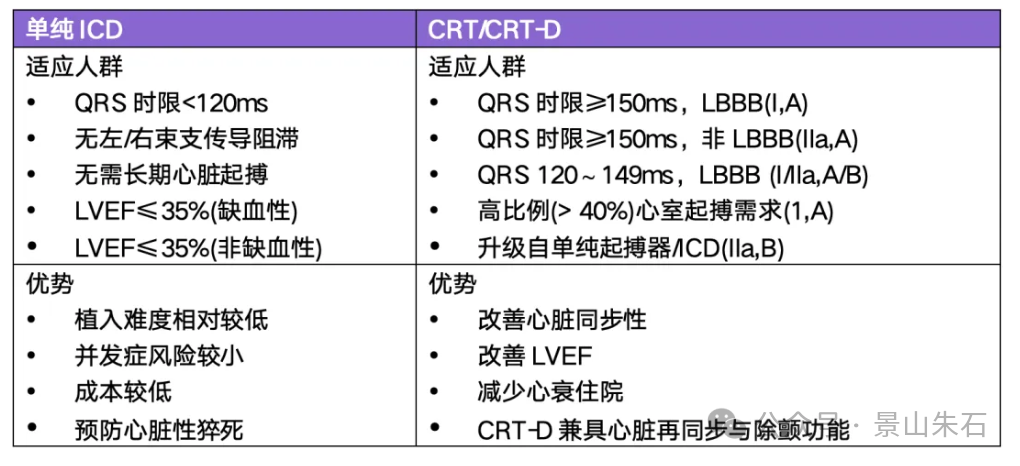
在心衰患者中,心脏再同步化治疗(CRT)和 ICD 常需要协同应用,即 CRT-D(结合除颤功能的 CRT 装置)。那么,在什么情况下应该选择单纯 ICD,什么情况下应该选择 CRT 或 CRT-D 呢?
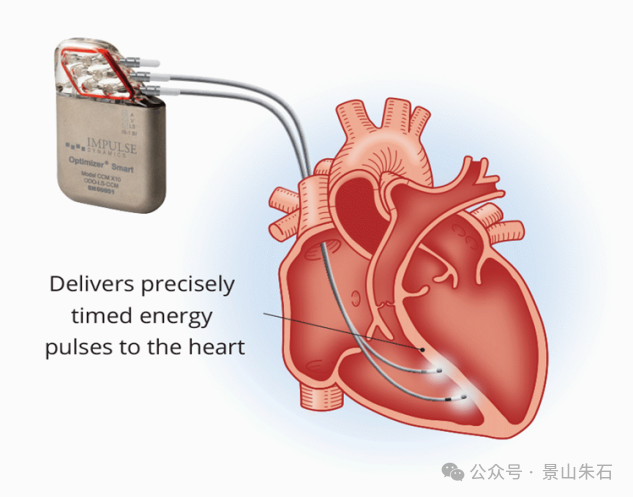
心肌收缩力调节器 (CCM)
原理:CCM在心脏搏动的绝对不应期给予电刺激信号,通过影响心肌细胞内的钙离子浓度,增强心肌收缩力。它不会引起额外的收缩或增加心肌耗氧量。
应用场景与患者选择:主要用于射血分数降低型心力衰竭 (HFrEF) 患者,尤其是对传统药物治疗反应不佳,且不符合CRT适应症的患者(例如QRS波群较窄的患者)。
NYHA心功能分级III级左右。
左心室射血分数 (LVEF) 在25%到45%之间。
QRS波群宽度小于130ms(这是CCM与CRT最主要的区别,它填补了窄QRS波群HFrEF患者的器械治疗空白)。
窦性心律。
适用阶段:适用于心衰的C期,在优化药物治疗后症状仍持续存在的患者。
CRT-D和CCM都是对于药物治疗无效且射血分数降低的心衰患者的器械介入选择。两者效果如何,目前尚无针对性的对比研究。两者治疗目标相似,部分患者群体重叠。
但适应证不同:CCM主要适用于LVEF在25%-45%之间、NYHA心功能Ⅲ级且QRS<130ms、药物治疗无效的慢性心衰患者。CRT主要适用于严重的心衰患者,当心衰患者持续用药不缓解,射血分数小于35%,同时心电图上存在房室收缩不同步,即QRS≥130ms的情况下。它们针对的是不同的心衰患者群体,相互补充。
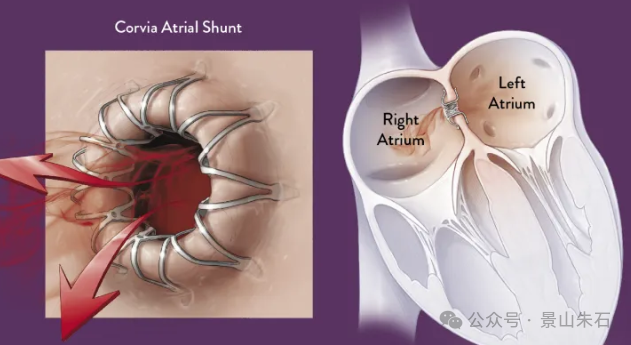
心房分流器 (Atrial Shunt Device)
原理:心房分流器是一种微创介入装置,通过在房间隔上创建一个受控的小孔,使左心房的血液分流到右心房,从而降低左心房压力,缓解肺淤血和呼吸困难症状。
应用场景与患者选择:主要用于射血分数保留型心力衰竭 (HFpEF) 患者,以及一部分射血分数降低型心力衰竭 (HFrEF) 患者,当药物治疗无法有效控制左心房压力升高引起的肺淤血症状时。HFpEF患者尤其缺乏有效的器械治疗手段。
NYHA心功能分级II-IV级,症状性心力衰竭。
左心房压力升高,导致肺淤血和呼吸困难。
对优化药物治疗反应不佳。
无明显的右心功能不全,且无重度肺动脉高压(避免右心衰竭加重)。
适用阶段:适用于心衰的C期和D期,特别是在HFpEF患者中,提供了一种新的症状缓解策略。
但要注意,Corvia Medical在《JACC: Heart Failure》公布心房分流器Corvia atrial shunt临床研究数据( REDUCE LAP-HF II),研究显示试验组(Corvia atrial shunt)和假手术组之间的疗效没有差异。这个东西到底有没有用,还需要更多的观察。
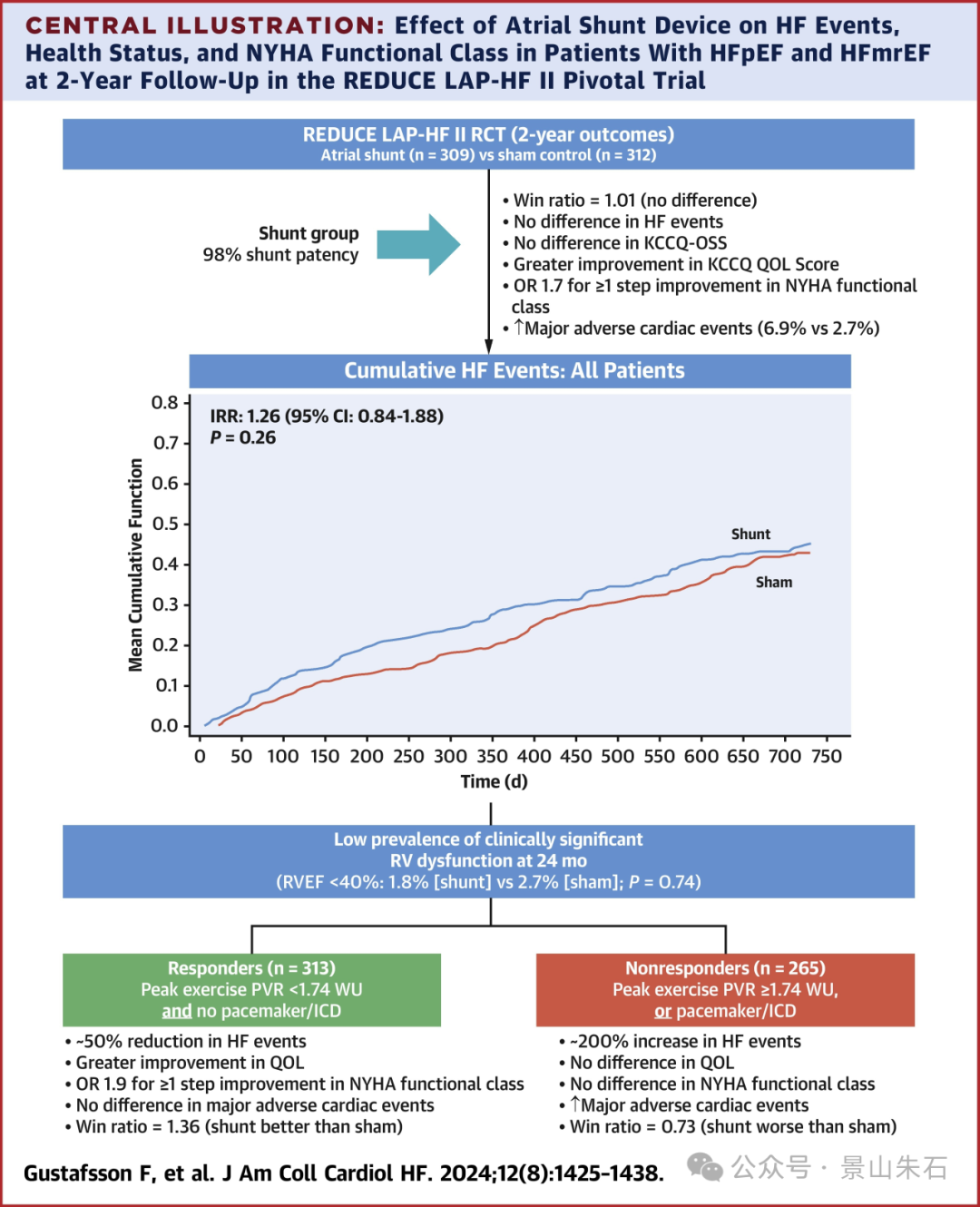
终末期心力衰竭(D期)的介入治疗
当患者的心衰已经进展到终末期,药物治疗和上述器械治疗效果不佳,症状严重,生活质量极差,且预期寿命有限时,需要考虑更高级的介入治疗。
主动脉内球囊反搏 (Intra-Aortic Balloon Pump, IABP)
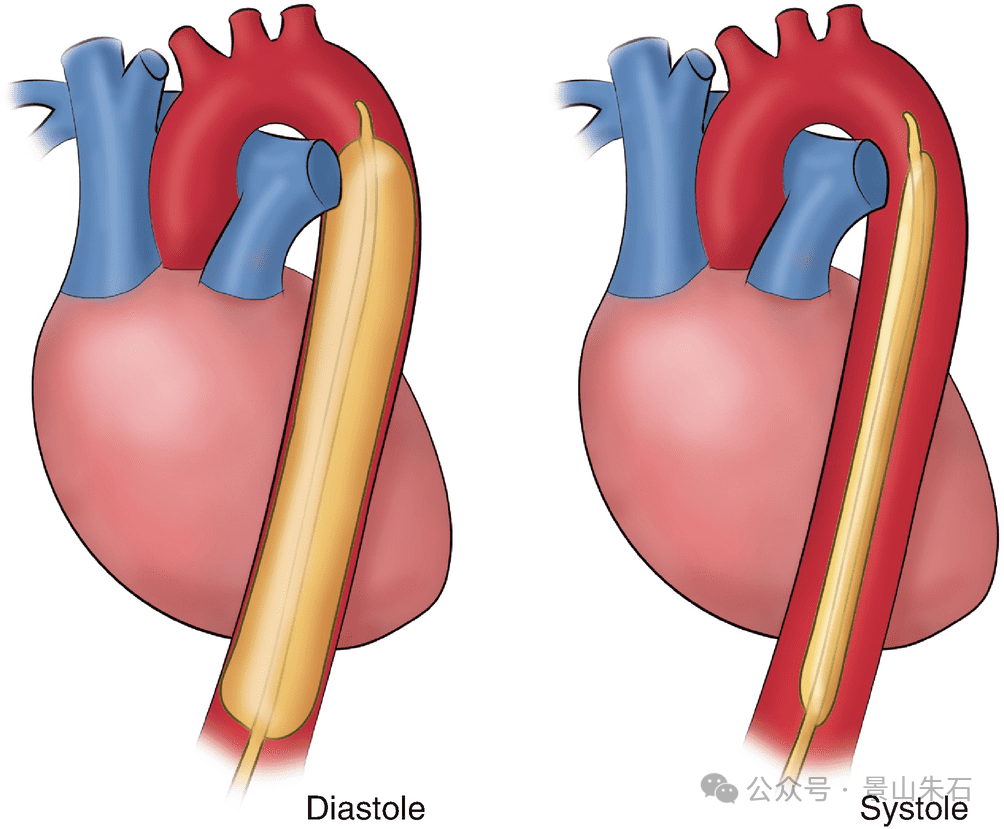
原理:IABP是一种短期机械循环支持装置。它通过股动脉置入,将一个球囊放置在降主动脉。
舒张期充气: 在心脏舒张期,球囊充气,增加主动脉舒张压,从而改善冠状动脉血流灌注,增加心肌氧供。
收缩期放气: 在心脏收缩期前,球囊快速放气,降低左心室后负荷(即左心室射血时遇到的阻力),从而减少心肌耗氧量,并能轻度增加心输出量。
应用场景与患者选择:IABP是一种短期辅助装置,主要用于急性心力衰竭失代偿,或心源性休克等危急情况,提供血流动力学支持,争取进一步治疗的时间。
急性心肌梗死合并心源性休克: 这是 IABP 最经典的适应症之一。它可以改善缺血心肌的供血,降低心脏负荷。
急性心肌梗死合并机械并发症: 如急性二尖瓣反流或室间隔穿孔,IABP 可暂时稳定血流动力学,为手术创造条件。
心脏手术(如冠脉搭桥术或瓣膜置换术)围手术期的高危患者: 用于预防或治疗术后低心排综合征。
顽固性心绞痛或室性心律失常: 当药物治疗效果不佳时,IABP 可能通过改善心肌血供和减少心脏负荷来帮助稳定病情。
作为等待更高级机械循环支持(如LVAD)或心脏移植的过渡治疗。
并非所有心源性休克患者都常规推荐使用IABP,特别是急性心肌梗死导致的心源性休克,其在改善死亡率方面的证据存在争议(如IABP-SHOCK II研究)。然而,在特定情况下(如合并机械并发症),其仍有重要作用。
适用阶段:主要用于心衰的急性失代偿期或D期(作为过渡支持),是一种临时的、挽救生命的措施。
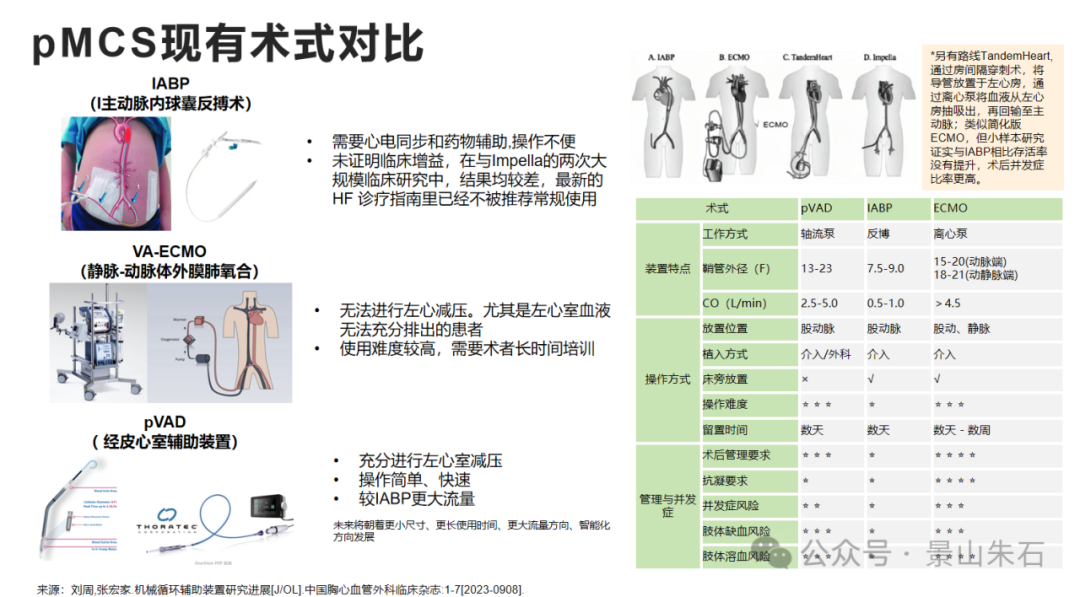
左心室辅助装置 (LVAD) / 右心室辅助装置 (RVAD) / 双心室辅助装置 (BiVAD)(统称为VADs)

原理:VADs是一种机械泵,通过手术植入体内,辅助相应心室将血液泵送到全身或肺循环。LVAD辅助左心室,RVAD辅助右心室,BiVAD则同时辅助左右心室。它们能有效减轻心脏负荷,改善全身器官灌注。
应用场景与患者选择:用于终末期心力衰竭患者,当药物治疗和传统器械治疗均无效,且患者预期寿命有限时。
NYHA心功能分级IV级。
LVEF极低,心脏功能严重受损。
对药物和CRT等治疗无反应或反应不佳。
作为心脏移植的“桥梁”: 患者在等待心脏移植期间,VAD 可以维持生命和器官功能。
作为永久替代治疗 (Destination Therapy, DT): 对于不适合心脏移植的患者,VAD 可作为长期支持,提高生活质量。
作为恢复前的过渡支持: 对于暂时性心力衰竭的患者,VAD 可以提供短期支持,直至心脏功能恢复。
患者需要有较好的依从性和社会支持,因为 VAD 需要日常维护和管理。
需排除严重的肝肾功能不全、严重脑血管疾病、严重感染、严重血液凝血障碍等禁忌症。
适用阶段:终末期心力衰竭 (D期),是心衰治疗的“最后一道防线”之一。
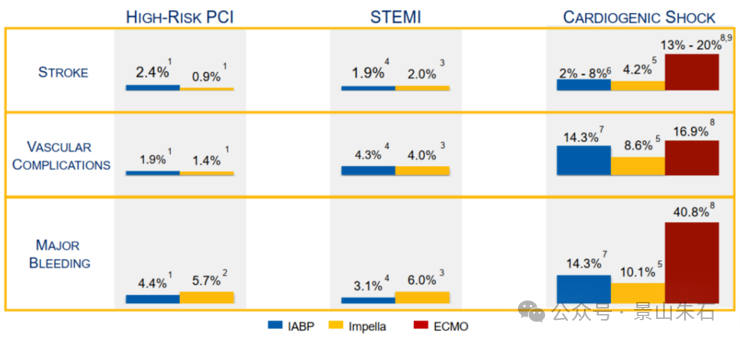
这里面不同的技术还是有一些细微的区别。IABP更方便更便宜,但是Impella(pVAD的一种)用于心源性休克和高危PCI术中保护治疗安全性效果较IABP和ECMO效果更好
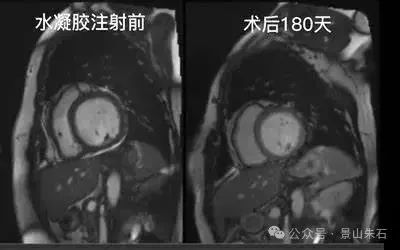
心内膜下水凝胶注射 (Intramyocardial Hydrogel Injection)
原理:这是一种相对较新的治疗方法,通过微创方式将一种生物相容性水凝胶注射到受损的心肌区域。水凝胶在心肌内形成一个支架,可以提供机械支撑,减少室壁应力,并可能改善心肌的结构和功能。
应用场景与患者选择:主要用于缺血性心肌病导致的心力衰竭,尤其是存在心室壁变薄和扩张的患者。目前仍处于临床研究阶段,尚未广泛应用于临床实践。
NYHA心功能分级II-IV级,LVEF降低的缺血性心肌病患者。
存在局部心肌变薄或室壁瘤。
不适合或不符合其他常规介入治疗指征的患者。
适用阶段:目前多见于C期或D期患者的临床试验,未来可能成为终末期心衰的潜在治疗方案。
这项技术效果非常明显,本来等待心脏移植的患者180天后心脏恢复正常大小,目前在西京医院陶凌教授做临床研究,但是患者选择和注射的心脏靶点还在探索阶段,技术的稳定性等待成熟的算法去普及,相信未来一定会有很好的发展。
猪心移植进展
里程碑式的临床尝试:
首例:2022年1月,美国马里兰大学医学中心 (UMMC) 成功将一颗经过10处基因编辑的猪心脏移植到57岁的终末期心力衰竭患者David Bennett体内。患者术后存活了约2个月(60天)。
第二例:2023年9月,UMMC又为58岁的Lawrence Faucette进行了第二例基因编辑猪心脏移植。该患者存活了约40天。
失败原因分析:尽管这些早期尝试的存活时间相对有限,但研究团队从中获得了宝贵的经验。对首例患者的分析发现,死亡可能与猪巨细胞病毒(pCMV/pRV)的再激活、以及患者本身免疫功能受损导致抗体介导的排斥反应有关。第二例患者的死亡也与抗体介导的排斥反应有关,团队发现患者体内抗猪抗体激增,导致心脏受损并最终失效。
国内进展:中国的科研团队也在异种移植领域取得了显著进展。例如,有团队于2023年和2024年先后成功完成了多例基因编辑猪-猴心脏异种移植手术,受体猴最长存活时间达到46天,创下国内先例。此外,中国科学家团队还在2024年5月完成了全球首例活体人异种肝移植手术,成功将基因编辑猪肝脏移植到一位肝癌重症患者身上,术后肝功能恢复正常,未发现超急性和急性排斥反应。
期待后续的进展造福人类。总结一下:
-END-
声明:本文转载于<急诊急救大平台>,以上仅代表作者本人观点,仅用于学习交流,版权归原作者所有