化疗是骨肉瘤综合治疗的重要组成部分
40余年前,骨肉瘤根治性手术治疗,即便是长骨骨肉瘤接受了标准的损毁性截肢术,仍然难以避免局部复发,远处转移和死亡。骨肉瘤单行手术后的5年生存率仅20%,其实通常仅5%-10%。无声的肺转移播散是骨肉瘤常见的远处转移。20世纪70年代,化疗开始应用于骨肉瘤治疗。大剂量足疗程的化疗,不仅显著提高了骨肉瘤患者的生存率,而且还有效提高了骨肉瘤患者的保肢率。目前,骨肉瘤治疗通常采用术前化疗-外科手术-术后化疗的综合治疗模式。目前,骨肉瘤患者的5年生存率已达到50%~80%。
术前化疗
术前化疗亦被称为新辅助化疗。对于经典型骨肉瘤IIB期和III期的患者,术前化疗的证据级别是1A类证据,I级推荐。其他情况的术前化疗证据及推荐级别详见表1。
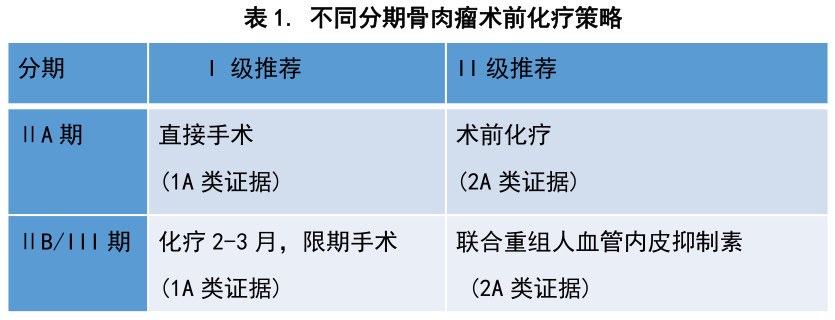
术前化疗前需要详细评估患者的一般情况,评估对其治疗的耐受性,综合制定治疗方案。目前观点认为,新辅助化疗并不能在辅助化疗的基础上提高生存率,但至少有以下优点:化疗期间有足够的时间进行保肢手术设计;诱导肿瘤细胞凋亡,促使肿瘤边界清晰化,使得外科手术更易于进行;有效的新辅助化疗可以降低术后复发率,使得保肢手术可以更安全地进行。术前化疗不仅可能控制肿瘤生长,控制微转移灶,术前化疗的另一优点是在患者体内进行了真正的个体化药敏试验。
骨肉瘤新辅助化疗推荐药物为大剂量甲氨蝶呤、异环磷酰胺、多柔比星、顺铂 (证据级别:1A/I级专家推荐),给药方式可考虑序贯用药或联合用药。选用两种或两种以上药物联合化疗,并保证足够的剂量强度。用药剂量参考范围为:甲氨蝶呤8-12g/m2(MTX化疗需行血药浓度监测),异环磷酰胺12-15g/m2,多柔比星90mg/m2,顺铂120-140mg /m2,以上为单药应用推荐剂量,若联合用药则需酌情减量,用药时间达2-3个月。自70年代术前化疗+手术+术后化疗应用于骨肉瘤治疗后,5年生存率获得了显著提高,由原来的10-20%提高到60-80%,但近30年来进入了平台期,尚未发现证据级别更高、能显著提高生存率的药物。有限的研究证据显示,重组人血管内皮抑制素对骨肉瘤具有抑瘤作用,与多柔比星联合用药具有协同作用,围术期用药能提高无远处转移生存率和疾病无进展生存率,安全性好。
术后化疗
术后化疗亦称为辅助化疗。术后化疗方案的制定,需要依据术前化疗疗效评价,及术后患者全身状况恢复情况而选择。骨肉瘤术前化疗疗效评估包括:(1) 症状与体征:肢体疼痛有无改善、皮温(与健侧对比)、肢体肿胀及表浅静脉怒张(与化疗前比较)、关节活动度(与化疗前比较)、患肢周径变化。(2) 实验室检查:碱性磷酸酶、乳酸脱氢酶的变化趋势。(3)影像学:X线、CT、MRI、ECT变化。需要根据以上结果,进行综合评估,判断新辅助化疗效果。(4)肿瘤坏死率的评估。
评价术前化疗疗效的可靠方法是组织病理学评估肿瘤坏死率。Huvos评级系统是应用最为公认的病理学评估金标准,见表2。肿瘤坏死率Ⅲ-Ⅳ级者为化疗反应好,推荐术后化疗采用与术前相同化疗方案;肿瘤坏死率Ⅰ-Ⅱ级者为化疗反应差,提示远期预后差,术后应提高剂量强度或修改化疗方案。组织病理学检测肿瘤坏死率检测,应注意对标本进行多点、足量取材。临床上开展肿瘤坏死率切片困难,工作量巨大,费用高,目前在国内作为术后组织病理学标准检测项目有一定难度。如条件允许,建议组织病理学检测肿瘤坏死率作为基本检测项目。
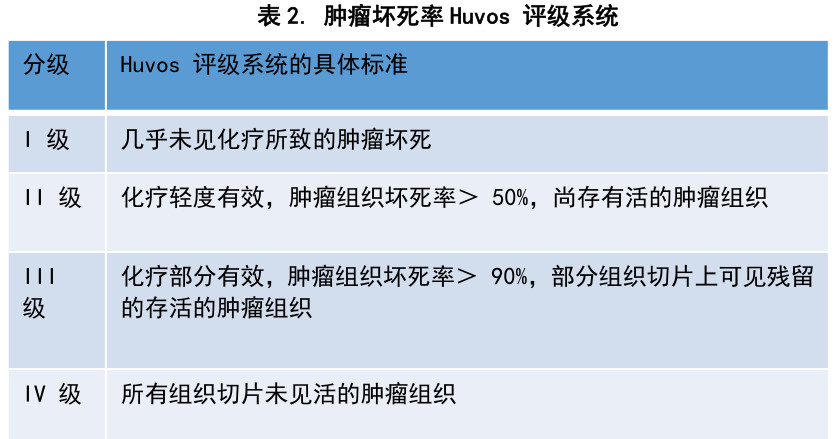
术后化疗方案选择的总体原则:未进行术前化疗的患者者,术后应常规进行一线化疗方案,即新辅助化疗方案(证据级别:1A/I级专家推荐)。接受过术前化疗的患者,术前化疗疗效好,维持原化疗方案(证据级别:1A/I级专家推荐);术前化疗疗效不好,调整化疗方案(证据级别:2A),包括考虑增加新药。不同分期的骨肉瘤治疗术后化疗策略,见表3。
转移进展的晚期骨肉瘤化疗
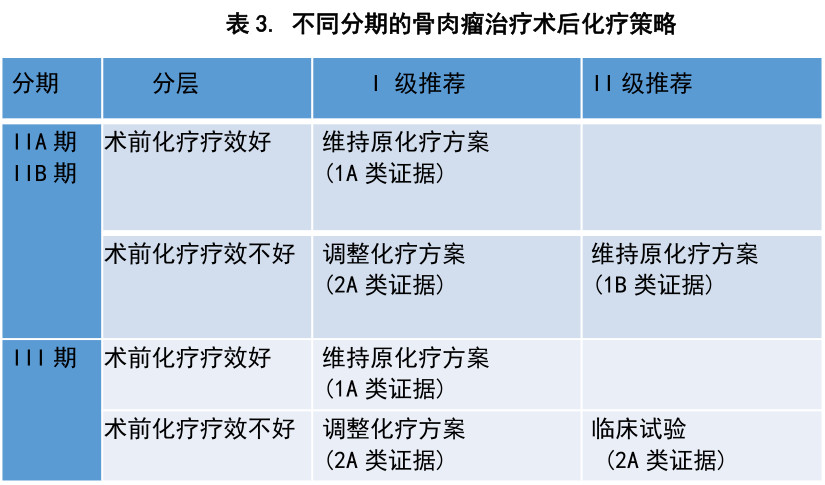
肺转移是骨肉瘤最常见的转移部位。对化疗有效的可切除的肺转移病灶,手术切除肺转移病灶是目前推荐的措施。已有多个研究证实该方案可改善骨肉瘤肺转移患者的预后,提高总体生存率。对化疗过程中出现的肺转移或化疗结束一年内出现的肺转移,可选择二线药物治疗。但二线药物治疗方案/临床试验的循证医学证据力度较弱,故列于可选策略中。目前应用较多的为吉西他滨联合多西他赛、依托泊苷联合异环磷酰胺、索拉非尼等方案。对于结束治疗1年以后出现的肺转移,推荐基于术前化疗方案的一线化疗药物治疗。不同时期出现肺转移的骨肉瘤治疗策略见表4。
目前,暂无证据级别较高、能明显延长晚期骨肉瘤患者生存时间的二线化疗方案。对于一线治疗失败的患者,首选推荐参加临床试验。临床试验让患者有获得最新治疗或者更好疗效的机会。骨肉瘤二线药物治疗方案循证医学证据力度均较弱。应用较多的二线化疗是吉西他滨+多西他赛,依托泊苷+环磷酰胺或异环磷酰胺,索拉非尼等方案。骨肉瘤的分子靶向治疗的临床研究证据十分有限,需要寻求新的靶向药物,为骨肉瘤的二线治疗带来新的契机。骨肉瘤二线化疗备选方案见表5。

化疗管理
骨肉瘤化疗的用药种类及剂量强度,对化疗的临床实施及安全性管理是一大挑战。骨肉瘤诊疗指南还专门针对骨肉瘤化疗的恶心呕吐、骨髓抑制及心脏毒性等问题的管理,制定进行了防治策略指南。
骨肉瘤化疗恶心呕吐的防治策略:用于骨肉瘤化疗的大剂量甲氨蝶呤,属于中度致吐风险化疗药。预防大剂量甲氨蝶呤化疗所致恶心呕吐,标准用药是5-HT3 受体拮抗剂+地塞米松的两联止吐方案(1A 类证据/I类推荐)。防治中度致吐风险的选择用药:NK1 受体拮抗剂,质子泵抑制剂,劳拉西泮,H2 受体拮抗剂(2A 类证据/II级推荐)。用于骨肉瘤化疗的异环磷酰胺、多柔比星、顺铂,均是高度致吐风险化疗药。预防其恶心呕吐,标准用药是5-HT3 受体拮抗剂+地塞米松+NK1受体拮抗剂的三联止吐方案(1A 类证据/I类推荐)。防治高度致吐风险的选择用药:质子泵抑制剂,劳拉西泮,H2 受体拮抗剂 (2A 类证据/II级推荐)。
骨肉瘤化疗所致粒细胞减少的防治策略:骨肉瘤的化疗的剂量强度与疗效密切相关。骨肉瘤化疗药物甲氨蝶呤、异环磷酰胺、多柔吡星、顺铂,强调大剂量足疗程。因此,骨肉瘤化疗出现严重骨髓抑制的风险较高,III-IV度粒细胞减少发生率12.4%~100%,中性粒细胞缺乏性发热发生率可达4%~38%。骨肉瘤标准化疗属于高风险化疗方案,推荐同时预防性应用粒细胞集落刺激因子(G-CSF)。既往大剂量MTX化疗出现IV度骨髓抑制,下次大剂量MTX 化疗时,预防性应用G-CSF(1A 类证据/I类推荐)。大剂量MTX化疗,常规预防性应用G-CSF(2A 类证据/II级推荐)。异环磷酰胺,或多柔比星化疗,预防应用G-CSF(1A 类证据/I类推荐)。骨肉瘤多药联合化疗,预防性应用G-CSF(1A 类证据/I类推荐)。
骨肉瘤化疗所致血小板减少症的防治策略:CIT的治疗主要包括血小板输注、促血小板生长因子。对出血风险较高的患者,为预防下一个化疗周期再次出现严重的血小板减少,可预防性使用血小板生长因子,从而保证化疗顺利进行(2B证据级别/III级推荐)。血小板生长因子停药指征是血小板≥ 100×109/L,或至血小板较用药前升高50×109/L。
骨肉瘤化疗所致贫血的防治策略:促红细胞生成素(EPO)及输血均为主要治疗手段。一般仅在重度及以上的贫血或伴有严重症状下考虑输血治疗。当Hb ≤ 100g/L时可考虑起始EPO治疗,必要时补充铁剂,使Hb平稳上升(每4 周上升10~20g/L),目标值为110~120g/L。
蒽环类药物心脏毒性的预防策略:多柔比星:多柔比星终生累积剂量<550mg/m2,应用心脏保护剂右雷佐生(1A 类证据/I级推荐)。换用多柔比星脂质(2A类证据/II级推荐)。多柔比星脂质体,应用心脏保护剂右雷佐生(1A 类证据/I级推荐)。其他心脏保护剂,如辅酶Q10,N- 乙半胱氨酸,抗氧化剂(维生素C和维生素E等),铁螯合剂(3 类证据/III级推荐)。
综上所述,骨肉瘤治疗的基本策略是综合治疗,而化疗是骨肉瘤综合治疗的重要手段。辅助化疗有利于提高骨肉瘤患者的生存率,术前化疗有利于提高保肢率。骨肉瘤化疗的一线用药是大剂量甲氨蝶呤、异环磷酰胺、多柔比星、顺铂。足量用药是骨肉瘤化疗疗效的基本保障。二线可选择化疗药物是吉西他滨、多西他赛、依托泊苷、索拉非尼等。骨肉瘤化疗的大剂量足疗程用药及青少年患者化疗等特殊问题、都强调应注重化疗用药的安全用药管理。积极防治骨肉瘤化疗所致的恶心呕吐,骨髓抑制及心脏毒性等近期和远期不良反应。
于世英
教授,主任医师
教授,主任医师,博士生导师、华中科技大学同济医学院同济医院肿瘤中心、中国抗癌协会癌症康复与姑息治疗专业委员会荣誉主委、湖北省医师协会肿瘤医师分会主任委员、《Oncology and Translational Medicine》主编、《全球肿瘤快讯》总编
本文来源:肿瘤医学论坛














