
脑胶质瘤主要由大脑和脊髓胶质细胞癌变所产生的最常见的原发性颅脑恶性肿瘤,具有发病率高、复发率高、死亡率高以及治愈率低的特点,成为我国重点防治的常见肿瘤之一。
危险因素
暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。
临床表现
颅内压增高、神经功能及认知功能障碍和癫痫发作。
常规影像学特点
影像常规检查目前主要包括CT和MRI。
这两种成像方法可以相对清晰精确地显示脑解剖结构特征及脑肿瘤病变形态学特征,如部位、大小、周边水肿状态、病变区域内组织均匀性、占位效应、血脑屏障破坏程度及病变造成的其他合并征象等。在图像信息上MRI优于CT。
CT主要显示脑胶质瘤病变组织与正常脑组织的密度差值,特征性密度表现如钙化、出血及囊性病变等,病变累及的部位,水肿状况及占位效应等。
常规MRI主要显示脑胶质瘤出血、坏死、水肿组织等的不同信号强度差异及占位效应,并且可以显示病变的侵袭范围。多模态MRI不仅能反映脑胶质瘤的形态学特征,还可以体现肿瘤组织的功能及代谢状况。
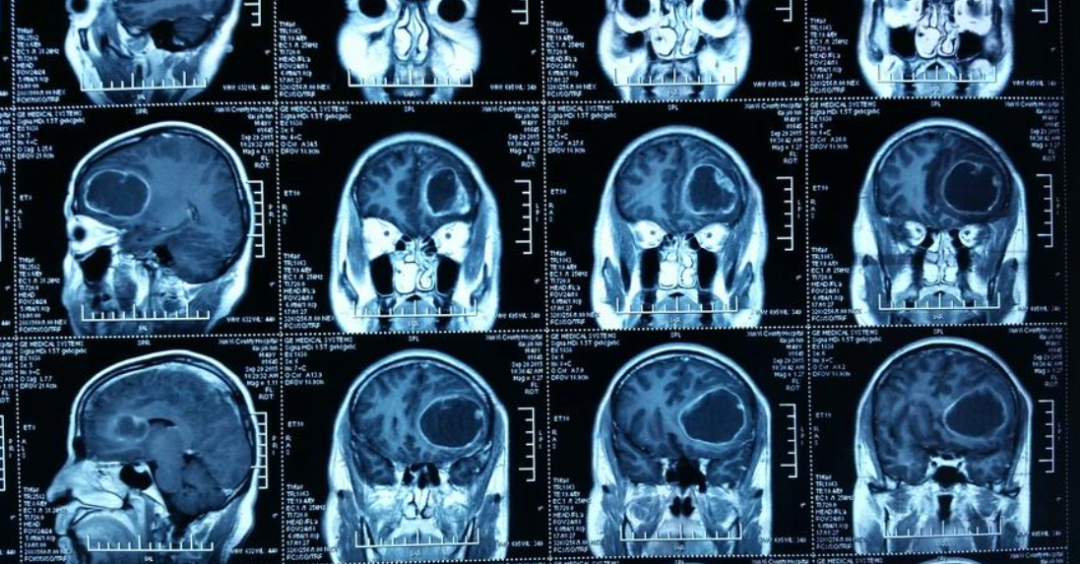
常规MRI扫描:主要获取T1加权像、T2加权像、FLAIR像及进行磁共振对比剂的强化扫描。脑胶质瘤边界不清,表现为长T1、长T2信号影,信号可以不均匀,周边水肿轻重不一。因肿瘤对血脑屏障的破坏程度不同,增强扫描征象不一。
低级别脑胶质瘤常规MRI呈长T1、长T2信号影,边界不清,周边轻度水肿影,局部轻度占位征象,如邻近脑室可致其轻度受压,中线移位不明显,脑池基本正常,病变区域内少见出血、坏死及囊变等表现;增强扫描显示病变极少数出现轻度异常强化影。
高级别脑胶质瘤MRI信号明显不均匀,呈混杂T1/T2信号影,周边明显指状水肿影;占位征象明显,邻近脑室受压变形中线结构移位,脑沟、脑池受压;增强扫描呈明显花环状及结节样异常强化影。
不同级别脑胶质瘤的PET成像特征各异。目前广泛使用的示踪剂为18F-FDG。低级别脑胶质瘤一般代谢活性低于正常脑灰质,高级别脑胶质瘤代谢活性可接近或高于正常脑灰质,但不同级别脑胶质瘤之间的18F-FDG代谢活性存在较大重叠,氨基酸肿瘤显像具有良好的病变-本底对比度对脑胶质瘤的分级评价优于18F-FDG,但仍存在一定重叠。
影像学特征性表现
低级别脑胶质瘤:
弥漫性星形胶质细胞瘤:MRI信号相对均匀,长T1,长T2和FLAIR高信号,多无强化。
少突胶质细胞瘤表现同弥漫性星形脑胶质瘤,常伴钙化。
PXA多见于颞叶位置表浅,有囊变及壁结节。增强扫描壁结节及邻近脑膜有强化。
第三脑室脊索瘤样脑胶质瘤位于第三脑室内。
毛细胞型星形细胞瘤以实性为主,常见于鞍上和小脑半球。
间变性脑胶质瘤
主要包括间变性星形细胞瘤、间变性少突胶质细胞瘤。
当MRI/CT表现似星形细胞瘤或少突胶质细胞瘤伴强化时,提示间变脑胶质瘤可能性大。
IV级脑胶质瘤:
胶质母细胞瘤;弥漫性中线胶质瘤。
胶质母细胞瘤特征为不规则形周边强化和中央大量坏死,强化外可见水肿。
弥漫中线胶质瘤常发生于丘脑、脑干等中线结构,MRI表现为长T1长T2信号,增强扫描可有不同程度的强化。
室管膜肿瘤:
主要指Ⅱ级和Ⅲ级室管膜肿瘤。
室管膜肿瘤边界清楚,多位于脑室内,信号混杂,出血、坏死、囊变和钙化可并存,瘤体强化常明显。
特殊类型:
黏液乳头型室管膜瘤为Ⅰ级。
黏液乳头型室管膜瘤好发于脊髓圆锥和马尾。
脑胶质瘤鉴别诊断
脑内转移性病变:
脑内转移性病变以多发病变较为常见,多位于脑皮层下,大小不等,水肿程度不一,表现多样,多数为环状或结节样强化影。脑内转移性病变的18F-FDG代谢活性可低于、接近或高于脑灰质;氨基酸代谢活性一般高于脑灰质。单发转移癌需要与高级别脑胶质瘤鉴别,影像学上可以根据病变大小、病变累及部位、增强表现,结合病史、年龄及相关其他辅助检查结果综合鉴别。
脑内感染性病变:
脑内感染性病变,特别是脑脓肿,需与高级别脑胶质瘤鉴别。两者均有水肿及占位征象,强化呈环形。脑脓肿的壁常较光滑,无壁结节,而高级别脑胶质瘤多呈菜花样强化,囊内信号混杂,可伴肿瘤卒中。绝大部分高级别脑胶质瘤的氨基酸代谢活性明显高于正常脑组织,而脑脓肿一般呈低代谢。
脑内脱髓鞘样病变:
与脑胶质瘤易发生混淆的是肿瘤样脱髓鞘病变,增强扫描可见结节样强化影诊断性治疗后复查,病变缩小明显,易复发,实验室检查有助于鉴别诊断。
淋巴瘤:
对于免疫功能正常的患者,淋巴瘤的MRI信号多较均匀,瘤内出血及坏死少见,增强呈明显均匀强化。18F-FDG代谢活性一般较高级别脑胶质瘤高且代谢分布较均匀。
其他神经上皮来源肿瘤:
包括中枢神经细胞瘤等。可以根据肿瘤发生部位、增强表现进行初步鉴别诊断。
脑胶质瘤影像学分级
常规MRI检查,除部分Ⅱ级脑胶质瘤(如多形性黄色星形细胞瘤、第三脑室脊索瘤样脑胶质瘤和室管膜瘤等)外,高级别脑胶质瘤MRI常有强化伴卒中、坏死及囊变。MRI有无强化及强化程度受到诸多因素影响,如使用激素、注射对比剂的量、机器型号及扫描技术等。
多模态MRI检查:包括DW1,PWI及MRS等。
DWI高信号区域,提示细胞密度大,代表高级别病变区。
PWI高灌注区域,提示血容量增多,多为高级别病变区。
MRS中Cho和Cho/NAA比值升高与肿瘤级别正相关。
18F-FDG PET:脑胶质瘤代谢成像的肿瘤组织对比度偏低,而氨基酸肿瘤显像具有较好的组织对比度,因此建议采用氨基酸PET脑显像评价脑胶质瘤级别。11C-MET PET评估准确度高于MRI,高级别脑胶质瘤的11C-MET代谢活性通常高于低级别脑胶质瘤,但高/低级别脑胶质瘤间仍存在一定的重叠,必要时建议使用18F-FDG PET动态成像分析以提高对脑胶质的影像学分级。
治疗后影像学评估
脑胶质瘤术后24-72小时内需复查MRI(平扫+增强),评估肿瘤切除程度,并以此作为脑胶质瘤术后基线影像学资料,用于后续比对。胶质瘤治疗效果的影像学评价参见RANO标准(如表1)。
表1脑胶质瘤治疗效果评估RANO标准
| 完全缓解(CR) | 部分缓解(PR) | 疾病稳定 (SD) |
疾病进展(PD) | |
| T1增强 | 无 | 缩小≥50% | 变化在-50%至+25% | 增加≥25% |
| T2/FLAIR | 稳定或减小 | 稳定或减小 | 稳定或减小 | 增加 |
| 新发病变 | 无 | 无 | 无 | 有 |
| 激素使用 | 无 | 稳定或减少 | 稳定或减少 | 不适用 |
| 临床症状 | 稳定或改善 | 稳定或改善 | 稳定或改善 | 恶化 |
| 需要满足条件 | 以上全部 |
以上全部 | 以上全部 | 任意一项 |
脑胶质瘤按照复发部位包括原位复发、远处复发和脊髓播散等特殊方式,其中以原位复发最为多见,组织病理学诊断仍然是金标准。假性进展多见于放/化疗后3个月内,少数患者可见于10-18个月内。常表现为病变周边的环形强化,水肿明显,有占位征象,需要结合临床谨慎判断。对于高级别脑胶质瘤氨基酸PET对鉴别治疗相关变化(假性进展、放射性坏死)和肿瘤复发/进展的准确度较高,放射性坏死多见于放疗3个月后,目前尚无特异性检查手段鉴别放射性坏死与肿瘤进展/复发。对于高级别胶质瘤,18F-FDG PET用于评价术后肿瘤复发和放射性坏死较MRI优势不明显,于高级别胶质瘤,18F-FDG PET用于评价术后肿瘤复发和放射性坏死较MRI优势不明显,氨基酸PET用于鉴别肿瘤进展和治疗相关反应具有较高的敏感度和特异度。对于低级别胶质瘤,18F-FDGPET不适用于评价肿瘤治疗反应,而氨基酸PET的评价作用也有限。定期MRI或PET检查,有助于鉴别假性进展和肿瘤进展/复发。
推 荐 阅 读
文末重磅福利:
好医术,懂医术,更懂医生!
【好医术】5周年史前钜惠
购课金额每满500元即送500元
买多少送多少,上不封顶!














