

脑转移瘤具有特殊的肿瘤内异质性和特征,可以阻碍免疫治疗。具体而言,脑免疫学受一系列不同于其他部位的免疫系统的学说管辖。血脑屏障在决定免疫制剂进入大脑中起着重要作用,导致脑实质内的免疫抑制环境。因此,转移性肿瘤是大脑中的避风港,这使它们成为主要威胁和治疗进步的重要目标。
脑转移表现出最多样化的免疫细胞景观之一,T细胞和中性粒细胞大量浸润。此外,小胶质细胞和巨噬细胞、淋巴细胞和星形胶质细胞等多种免疫因子完善了转移性肿瘤细胞的免疫微环境。
肿瘤相关髓细胞和小胶质细胞
髓细胞的激活可以促进细胞侵袭、血管生成、转移和免疫抑制。据估计,骨髓来源的细胞占脑转移瘤内细胞的 32.7%。然而,最近的研究表明,虽然与非肿瘤组织相比,胶质瘤中与肿瘤相关的髓样细胞和小胶质细胞 (TAM) 可以显著增加,但淋巴细胞在脑转移中更为普遍。
髓细胞有两个不同的来源,包括外周(骨髓来源的巨噬细胞;CD49D+)或卵黄囊(小胶质细胞;CD49D-)。它们倾向于在脑肿瘤级别较高的环境中积累,并与肿瘤细胞进行显著的双向交汇。
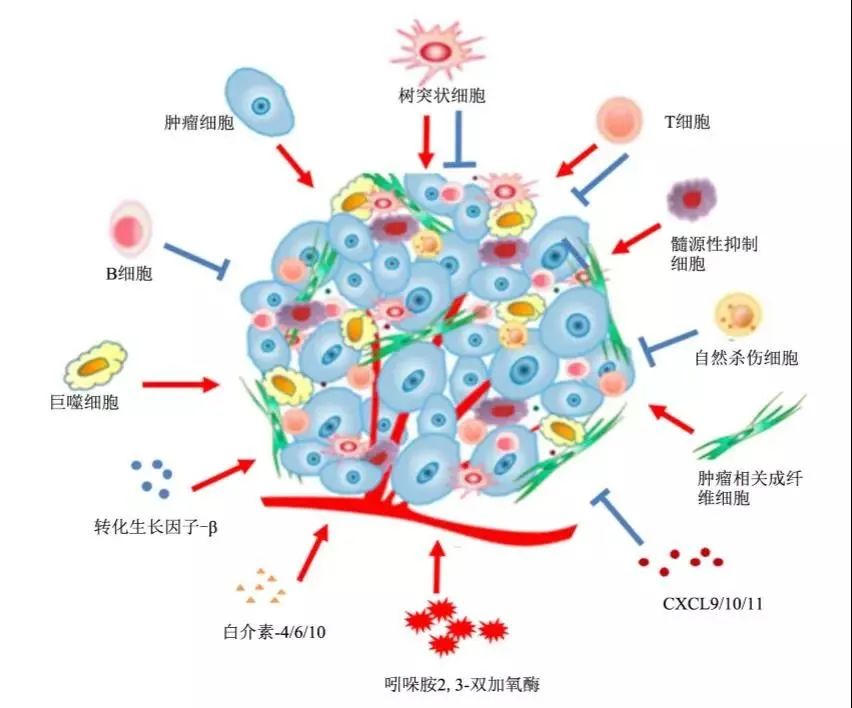
小胶质细胞是大脑免疫微环境的核心组成部分。临床前观察提出了小胶质细胞在转移过程的外渗阶段的作用。在炎症的情况下,髓细胞是从循环单核细胞中募集的。小胶质细胞的免疫作用涉及抗原的呈递、通过一氧化氮和超氧化物的细胞毒活性以及吞噬能力。
在脑转移环境中,小胶质细胞显示出对 T 细胞产生免疫抑制作用并介导对免疫检查点封锁的抵抗的白介素 (IL)-6 的受限上调。此外,小胶质细胞限制了 TREM1 受体的表达,TREM1 受体在神经炎症期间调节促炎反应。小胶质细胞释放的趋化因子,如 CXC 基序趋化因子 5 (CXCL5) 和 CXCL8,在脑转移的情况下增加;这些趋化因子将免疫抑制的中性粒细胞募集到转移性生态位。
小胶质细胞表达多种蛋白质,这些蛋白质在免疫诱导和抑制中起着相互矛盾的作用。高迁移率族框 1 蛋白 (HMGB1) 的表达促进了抗原呈递和适应性免疫系统的激活。然而,TAM 也可以表达免疫抑制蛋白,如 PD-L1,通常由炎症和/或坏死触发。这些生物学特性使 TAM 能够调节和保持免疫平衡,防止任何肿胀,并最终防止颅骨受限区域内的损伤。然而,转移性肿瘤细胞劫持了 TAM 的免疫抑制能力,以逃避免疫系统并促进其自身的存活。
TAM 还分泌一氧化氮并排出大脑中的肿瘤微环境中的氨基酸,这些氨基酸对于激活细胞毒性 T 细胞至关重要,从而导致免疫信号通路的阻断,例如 IL-2 信号通路,这是一种重要的刺激通路免疫系统。活性氧的产生导致蛋白质、脂质和核酸的降解,促使 T 细胞发生凋亡。同一微环境中活性氧和一氧化氮的共存进一步导致过氧亚硝酸盐的形成,从而导致 T 细胞受体的亚硝基化。这扰乱了 T 细胞与肿瘤细胞的相互作用机制,并可能导致转移性免疫抵抗。
小胶质细胞也已被证明表达神经营养因子 (NT)-3 以调节免疫细胞活化。NT-3 与其他神经营养因子类似,在刺激和控制神经发生方面起着重要作用。在转移性环境中,表达 NT-3 的小胶质细胞被劫持以协助脑转移的形成。此外,骨髓细胞和小胶质细胞分泌 IL-10 和转化生长因子 β (TGFβ) 会诱导 M2 TAM 和调节性 T 细胞的活性,这些细胞已知会抑制免疫反应。在某些情况下,小胶质细胞的作用延伸到引导转移细胞侵入大脑。小胶质细胞壁位于转移细胞和脑实质之间的边界处。
巨噬细胞通常在极化状态之间调节:M1 和 M2。虽然 M1 状态是促炎的,诱导针对外来病原体和癌细胞的 Th1 反应,但 M2 状态有助于免疫抑制和细胞修复。尽管在脑转移的情况下对巨噬细胞极化的理解仍然有限,但 TAM 通常假定 M2 组成,导致免疫抑制并协助肿瘤细胞逃避免疫。然而,巨噬细胞的极化在大脑的不同区域之间是不同的。在实质转移中,细胞因子如淋巴毒素 β 的释放和 NF-κB1 活性的增加表明直接参与了巨噬细胞的 M2 极化。随后,这导致生长因子的分泌、细胞外基质 (ECM) 的重塑和血管生成。
TGFβ、基质金属蛋白酶 (MMP) 2、MMP9、导管素、组织蛋白酶和 A 类清道夫受体 (SRA) 的释放在促转移性 ECM 重塑中起主要作用,而血管内皮生长的分泌因子 A (VEGFA) 和血小板衍生生长因子 (PDGF) 有助于血管生成。
进入脑实质后,转移性肿瘤细胞会释放因子将 TAM 募集到肿瘤微环境中。VEGFA、趋化因子配体 (CCL) 2、CCL5、CCL9、CCL18 和集落刺激因子 1 (CSF1) 等因子会在此类环境中释放。用于靶向 TAM 的治疗策略之一是集落刺激因子 1 受体 (CSF1R) 抑制剂,其抑制 TAM 释放促存活因子。CSF1R 的抑制要么耗尽 TAM,要么使 TAM 去极化。
脑微环境中,转移性肿瘤细胞和 TAM 之间的相互作用。
(1) 进入脑实质后,肿瘤细胞释放细胞因子和趋化因子,如 CSF1、GM-CSF、MCP-1、HGF、SDF-1 和 CX3CL1,将外周和脑内小胶质细胞的髓细胞募集到肿瘤利基。
(2) 来自骨髓和卵黄囊的髓细胞进入大脑,小胶质细胞向肿瘤细胞迁移。
(3) TAMs释放生长因子,如EFG、IL-6、TGF-β、IL-1β等蛋白酶。
(4) 这促进了肿瘤的存活和生长。
与小胶质细胞不同,髓细胞是较差的 APC。除了阻止自然杀伤 (NK) 细胞和 T 细胞裂解的主要组织相容性复合体 (MHC) Ⅰ型分子外,它们还表达人类白细胞抗原 (HLA)-G 和 HLA-E 的同种型。尽管如此,它们的免疫抑制能力是通过抑制性分子(如 PD-L1 和 PD-L2)的共表达以及抑制性趋化因子(如 IL-10、TGFβ、CCL5、CCL20 和 CCL22)的释放来说明的,可防止激活各种癌症中的适应性免疫反应。
T 细胞和NK 细胞
脑转移瘤中分析表明淋巴细胞比例显著升高,黑色素瘤脑转移瘤表现出最多的淋巴细胞浸润,而 CD8+ T 细胞则占主导地位其他淋巴细胞部分。然而,转移性肿瘤周围的炎症水平因患者而异,也因癌症类型而异,因为脑转移细胞周围的 T 细胞浓度可以从零到非常高不等。
CD8+ T 细胞密度的差异可能与脑转移发生的时间有关。这种变异的另一种解释可以在转移细胞的蛋白质表达中看到。例如,高 PD-L1 表达可缓解免疫逃避,并允许转移细胞逃避 T 细胞的检查点。此外,调节性 T 细胞表达的FOXP3 和程序性细胞死亡蛋白 1 (PD-1) 有利于转移性肿瘤微环境中的免疫抑制。
通过免疫检查点调节 T 细胞。T 细胞上 CTLA4 和 PD-1 的表达作为免疫检查点,肿瘤细胞可以通过该检查点结合和灭活 T 细胞。抑制效应 T 细胞反应为转移性癌细胞提供了增殖的机会。底部:免疫检查点抑制剂,如抗 CTLA4、抗 PD-L1 和抗 PD-1 抗体,可防止肿瘤细胞对 T 细胞活化施加制动,从而导致 T 细胞活化、免疫攻击和肿瘤细胞死亡。
在临床结果和存活率方面,已经证明免疫反应增加和转移性肿瘤细胞毒性 T 细胞浸润的患者具有较好的预后。黑色素瘤脑转移比乳腺癌脑转移表现出更高的 T 细胞浸润。这可能是一些免疫治疗方案在改善转移性黑色素瘤至大脑患者的存活率方面取得成功的原因。
此外,已经证明具有高水平效应 CD3+、细胞毒性 CD8+ 或记忆 CD45 RO+ T 细胞的脑转移浸润可提高存活率。此外,进入脑转移区的 T 细胞增加会降低白质束的完整性,这提供了一种使用扩散张量 MRI 识别大脑中免疫活性微环境的方法。
血脑屏障也在限制细胞毒性 T 细胞浸润方面发挥作用。血管生成和新血管形成是转移的关键标志。尽管如此,血管生成潜力的大小因癌症类型而异。
除了表达抑制蛋白和受体,如细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA4)、PD-1、淋巴细胞激活基因 3 (LAG3)、T 细胞免疫球蛋白和含有粘蛋白结构域的 3 (TIM-3) 、诱导性 T 细胞共刺激物 (ICOS) 和具有 Ig 和 ITIM 结构域的 T 细胞免疫受体 (TGIT),调节性 T 细胞也可以分泌大量免疫抑制细胞因子。
据报道,IL-10、IL-35 和 TGFβ 由肿瘤微环境中的调节性 T 细胞释放。已证明调节性 T 细胞可以排出肿瘤微环境中的免疫刺激细胞因子,如 IL-2,从而使抗肿瘤 Th1 免疫反应失活。最近,表明通过 MHC I 类相关蛋白表现出泛癌细胞识别的 T 细胞受体在黑色素瘤中缺乏可检测的反应性。为 T 细胞提供 MC.7.G5 T 细胞受体使它们能够杀死自体黑色素瘤。
NK 细胞还参与脑肿瘤微环境中的肿瘤内免疫反应。它们已被证明存在于转移性脑肿瘤、神经胶质瘤和颅咽管瘤中。与细胞毒性 T 细胞一样,由于肿瘤细胞释放抗炎分子(如 TGFβ),NK 细胞功能在脑肿瘤患者中经常减弱。此外,分泌环氧合酶 (COX) 和前列腺素 E2 等炎症介质的肿瘤会抑制 NK 细胞的抗肿瘤活性。
中性粒细胞
尽管是最丰富的循环免疫细胞,但中性粒细胞在脑转移瘤免疫微环境中的功能仍不清楚。然而,最近的进展已经阐明了控制脑转移微环境中中性粒细胞募集和激活的一些机制。中性粒细胞可以通过 TAM 分泌 CXCL8 化学引诱物被招募到大脑微环境中。脑转移细胞对 ITGA3 和 CXCL17 的上调进一步增加了中性粒细胞。腺苷受体的过度表达抑制中性粒细胞的促炎表型。此外,过表达脑转移细胞中的CD177影响中性粒细胞迁移和活化并抑制 T 细胞增殖。此外,MET的上调与免疫抑制性中性粒细胞向脑转移中的免疫微环境的募集有关。
最近,已经表明脑转移细胞过度表达表观遗传修饰蛋白,EZH2 的增强子,以刺激抑制募集的中性粒细胞的信号通路。在脑转移的情况下,EZH2 磷酸化将其功能从甲基转移酶转变为增加c-JUN表达的转录因子。这导致促肿瘤发生的炎性细胞因子的分泌,包括 G-CSF,其将 Arg1+ 和 PD-L1+ 免疫抑制性中性粒细胞募集到大脑中以驱动转移生长。通过 G-CSF 阻断抗体或免疫检查点阻断疗法与 Src 抑制剂相结合阻断中性粒细胞亚群的流入,阻止了脑转移。此外,中性粒细胞可以在启动脑转移生态位方面发挥作用。已经表明S100 钙结合蛋白 A (S100A)-8 和 S100A9 在大脑的转移前生态位中被上调,导致中性粒细胞的募集,从而支持随后的转移播种和定植。
中性粒细胞在脑转移的情况下具有预后价值。外周血中中性粒细胞与淋巴细胞的高比例与存活时间缩短有关,即使在手术切除脑转移后也是如此。此外,在接受立体定向放射外科治疗的患者中,治疗后的中性粒细胞与淋巴细胞的比例与总体生存率较差有关。然而,在携带 EGFR 突变的非小细胞肺癌 (NSCLC) 患者中,嗜中性粒细胞与淋巴细胞的比率≤2.99 与延长生存期相关。因此,中性粒细胞与淋巴细胞的比率可以作为特定脑转移患者有用的预后生物标志物。
星形胶质细胞
星形胶质细胞是中枢神经系统特有的一些最丰富的细胞类型,在介导大脑中的组织特异性通讯中发挥重要作用。因此,优先在大脑内生长的转移瘤很可能必须找到适应这些不熟悉的细胞,并与之积极互动的方法。已知脑转移细胞在与星形胶质细胞相互作用时会表达高水平的 IL-1β。这会导致 Notch 信号通路的激活,从而增加癌症干细胞的干性并推动它们在肿瘤微环境中的生长。研究表明,已建立的脑转移瘤内的癌细胞与相邻微环境中的星形胶质细胞形成功能性间隙连接,从而为双向通讯创造了一个管道以支持生长。通过这些间隙连接,癌细胞通过提供 cGAMP 来重新编程星形胶质细胞以诱导促炎程序,其特征是产生干扰素 α (IFNα) 和肿瘤坏死因子α (TNFα)。反过来,这些细胞因子通过激活癌细胞内的信号转导和转录激活因子 (STAT) 1 和核因子-κB (NF-κB) 信号来支持转移的生长。通过药理方案干扰间隙连接的形成,可以阻断这种异型信号回路,从而减轻脑转移的产生。此外,星形胶质细胞具有释放可重塑 ECM 的因子的能力,例如 MMP 和乙酰肝素酶,这有助于转移细胞侵入血脑屏障并促进随后的转移定植。
星形胶质细胞与脑转移癌细胞的相互作用。转移性癌细胞释放 cGAMP 以重新编程星形胶质细胞的行为并增加 STAT3 信号。反过来,星形胶质细胞与大脑中的转移性癌细胞形成间隙连接以交换刺激信号。
脑转移细胞在转移病灶周围的反应性星形胶质细胞亚群中诱导并维持由 STAT3 驱动的促转移程序的共同选择。这些反应性星形胶质细胞通过对先天性和获得性免疫系统的调节作用使转移细胞受益。阻断反应性星形胶质细胞中的 STAT3 信号可以减少来自不同原发肿瘤来源的实验性脑转移,即使在定植的晚期阶段也是如此。一种安全且具有口服生物可利用性的抑制 STAT3 的治疗在患有晚期全身性疾病(包括脑转移)的患者中表现出显着的抗肿瘤作用。
脑转移中的免疫检查点
从进化的角度来看,癌细胞已经发展出各种特征来逃避免疫监视。PD-L1 是一种免疫检查点分子,可调节免疫稳态并防止自身免疫。在病理条件下,例如胰腺癌,PD-L1 的表达保护肿瘤细胞免受细胞毒性 T 细胞的激活。与 CTLA4 等其他免疫监视分子不同,PD-1 的表达不仅限于 T 细胞,也发生在 B 细胞中。这突出了 PD-L1 表现出的更广泛的功能。
目前尚不清楚转移性脑细胞如何形成机制来克服 T 细胞的影响。严重依赖打破 T 细胞与脑转移性癌细胞之间的相互作用以及特定代谢途径的消融导致癌细胞中促生存机制的激活,为对抗致命进展提供了潜在的治疗途径。PD-1 受体首先在胸腺细胞上发现,以响应促凋亡刺激。进一步的研究将这种受体的功能与免疫耐受联系起来。
与 CTLA4 一样,PD-1 属于 CD28 家族,以其抑制作用而闻名。在抗原刺激下,PD-1 的尾部区域被磷酸化,导致 SHP-2 的募集和激活。随后与基于 SRC 的家族受体形成复合物,导致原发性脑肿瘤中 ERK 和 RAS 信号通路的激活。发生这种情况的确切机制尚不清楚,但似乎与 PD-1 抑制 IFN 诱导的一氧化氮产生、抑制葡萄糖代谢以及抑制精氨酸和色氨酸氨基的能力有关。
最近的研究表明,PD-1 表达的治疗性降低会导致肿瘤细胞中的细胞保护性自噬诱导,从而提高它们的存活率。已知两种 PD-1 受体配体:属于 B7 家族的 PD-L1 和 PD-L2。观察到 PD-1、PD-L1 和 PD-L2 在原发性和转移性肿瘤之间差异表达。对转移性病变中这些免疫检查点的进一步组织病理学检查显示,它们的表达与较短的总生存期相关。
PD-1 和 CTLA4 对脑转移瘤中 T 细胞的抑制作用似乎也取决于全身性疾病的状态。在黑色素瘤脑转移中,仅当存在颅外肿瘤时才观察到颅内免疫检查点抑制的功效。作为对免疫检查点治疗的反应,颅外存在进一步增加了 CD8+ T 细胞和 TAM 向脑肿瘤的运输。此外,肿瘤诱导的外周免疫抑制会促进非小细胞肺癌患者的脑转移。外周 TAM 上 PD-L1 的表达增加会降低 T 细胞的激活和运输,从而导致较差的结果。
限制对检查点抑制剂免疫反应的潜在机制还包括大脑通路和血管通透性。尽管存在不同程度的渗漏,但脑肿瘤环境中的血管通透性低于颅外肿瘤。抗 PD-1 和抗 CTLA4 阻断抗体进入颅内肿瘤的途径有限,因此它们减少 PD-1 和 CTLA4 对 T 细胞抑制的能力减弱。然而,针对脑转移细胞的有效免疫反应可能依赖于抗原特异性 T 细胞的产生,这是颅外肿瘤部位 PD-1 阻断或 CTLA4 抑制的结果。此外,脑转移瘤的肿瘤抗原如引流淋巴结,导致 T 细胞启动的诱导和抗原特异性 T 细胞从颅外肿瘤引流淋巴结中的检查点抑制中释放。
脑转移细胞在遗传和表型上可能与其原发肿瘤来源不同。脑转移的基因组特征显示,在 53% 的病例中,在匹配的原发肿瘤样本中未检测到脑转移的临床信息改变。远端颅外和区域淋巴结转移与脑转移高度不同,因此检测到与脑转移中对 PI3K/AKT/mTOR、CDK 和HER2/EGFR 抑制剂的敏感性相关的改变。原发性和转移性肿瘤细胞之间的这些差异还包括免疫反应、炎症相关通路、NF-kB1 活性和细胞因子谱的改变。例如,淋巴毒素 β 表达与脑转移灶中实质巨噬细胞的 M2 极化直接相关。
当针对转移过程的多个途径时,针对转移的治疗进展特别成功。在临床环境中,通过模拟 T 细胞介导的抗癌反应的干预措施观察到治疗效果和显著延长生存期。正在进行的临床前研究表明,阻断 T 细胞和癌细胞之间的相互作用后,黑色素瘤、肺癌和乳腺癌模型的生存获益。尽管如此,相互作用的机制仍然是开放的,因为这种疗法的临床转化只能证明对黑色素瘤脑转移的疗效。
通常,脑转移患者接受皮质类固醇治疗以减轻肿瘤相关炎症的症状。虽然接受伊匹单抗和皮质类固醇治疗的黑色素瘤脑转移患者表现出更差的结果,NSCLC 脑转移患者似乎与纳武单抗不同。在一个病例报告中,尽管同时接受了高剂量皮质类固醇治疗,但仍获得了纳武利尤单抗的效果。
免疫疗法组合
联合免疫疗法可以比单一疗法有更好的治疗效果。使用高维单细胞分析,抗 CTLA4 加抗 PD-1 的联合治疗引发的细胞反应与任何一种单一疗法诱导的反应部分不同。该组合介导了从表型耗尽的 CD8+T 细胞扩增到活化效应 CD8+T 细胞扩增的转变。最近,伊匹单抗和纳武单抗的组合显示出最好的疗效。
免疫疗法和放射
立体定向放射外科手术或全脑放射治疗一直是治疗有症状的脑转移患者的主要方法。在转移组织放射治疗的效果相结合的DNA损伤,损伤相关的分子模式和MHC-I分子的有效表达抗原呈递。
总体而言,辐射无法产生持久的抗癌作用。同时,癌细胞的免疫检查点和抑制性微环境有助于致瘤性。
研究表明,立体定向放疗和伊匹单抗联合治疗黑色素瘤脑转移是安全的。此外,与仅用放射治疗相比,纳武单抗和立体定向放射的组合提高了总生存期和无进展生存期。对黑色素瘤、非小细胞肺癌和肾细胞癌脑转移患者的荟萃分析表明,将免疫检查点抑制剂与立体定向放疗一起使用可将 1 年总生存率提高至 65%,因为相比之下,单药治疗的病例为 52%。另一项研究还显示,与单独放射治疗的 12.9 个月相比,中位总生存期提高了 24.7 个月。辐射导致癌细胞上 PD-L1 的上调,这使它们对抗 PD-L1 疗法敏感。它增加了血脑屏障通透性,使免疫疗法更好地渗透到大脑中。然而,高剂量的类固醇与全脑放射治疗一起用于减少颅内水肿,由于其免疫抑制作用而造成问题。这导致许多中心不再对所有脑转移患者常规使用类固醇。
免疫疗法和其他疗法
化疗确实可以通过增加 T 细胞反应和破坏 TAM 的活性来增强免疫检查点抑制剂的作用。尽管如此,其在脑转移中的确切作用机制仍然未知。在非小细胞肺癌中,除化疗外,派姆单抗已成为标准疗法。除了免疫检查点阻断外,靶向治疗可以进一步增强治疗效果。MAPK 通路的抑制增加了树突状细胞、T 细胞和 NK 细胞的功效,并降低了脑肿瘤中肿瘤相关成纤维细胞和 TAM 的活性。
大脑中的血管生成会影响免疫功能。血管异常是脑转移的标志,有助于逃避免疫。升高水平的促血管生成因子,如 VEGF 和血管生成素 ,在这个过程中起主要作用。然而,血管生成可以是一把双刃剑。虽然新血管系统的形成可能会增加肿瘤免疫微环境中的炎症和效应 T 细胞进入现场的运输,但异常血管系统会限制免疫细胞的运动。VEGF 改变内皮细胞和免疫细胞上粘附分子的表达,限制正确的粘附和随后进入肿瘤微环境的通道。因此,血管生成抑制剂可以使脉管系统正常化,并增加 T 细胞向转移部位的运输,将免疫抑制性肿瘤微环境转变为免疫支持性微环境,并增加免疫检查点抑制剂的治疗潜力,如恶性胶质瘤中所见。
这两种方案的组合可以减少炎症分子的聚集和肿瘤部位周围的水肿,随后减少对甾体治疗的需要。此外,贝伐单抗可减少表达 S100A9 的 TAM,从而减少免疫抑制并恢复抗肿瘤免疫。
手术和免疫治疗
这两种方式可以增强治疗效果并改善患者预后。神经外科的进步显著提高了手术切除脑转移瘤的安全性。手术切除可以改善患者的表现并减少类固醇的使用。在免疫调节方面,大脑仍然是一个特殊的器官,血脑屏障是这种免疫状态的主要贡献者。肿瘤微环境在脑转移中的免疫抑制作用强调需要可以逆转免疫抑制的新治疗策略。这些策略应旨在支持巨噬细胞的 M1 状态或帮助募集细胞毒性 T 细胞。它们还可以靶向免疫抑制元件,如调节性 T 细胞和 TAM。
到目前为止,免疫疗法未能在乳腺癌脑转移中显示出显著的效果(与转移性黑色素瘤和非小细胞肺癌不同)。因此,应强调旨在将冷脑转移肿瘤转变为热脑转移肿瘤的方法,并应评估诱发自身免疫的潜在风险。同样重要的是要考虑到免疫抑制是一种保护机制,可以保护大脑免受过度炎症和随后的水肿的影响,这些炎症和随后的水肿可能会损害大脑的敏感结构,从而导致损伤。
-----------END--------------

主要文献:
[1]Sampson JH, Gunn MD, Fecci PE, et al. Brain immunology and immunotherapy in brain tumours. Nat Rev Cancer. 2020;20(1):12–25.
[2]Fares J, Kanojia D, Rashidi A, et al. Genes that mediate metastasis across the blood-brain barrier. Trends Cancer. 2020;6(8):660–676.
[3]Hu X, Deng Q, Ma L, et al. Meningeal lymphatic vessels regulate brain tumor drainage and immunity. Cell Res. 2020;30(3):229–243.
[4]Absinta M, Ha S-K, Nair G, et al. Human and nonhuman primate meninges harbor lymphatic vessels that can be visualized noninvasively by MRI. Elife. 2017;6:e29738.
[5]Da Mesquita S, Fu Z, Kipnis J. The meningeal lymphatic system: A new player in neurophysiology. Neuron. 2018;100(2):375–388.
声明:本文由肿瘤学院作者整理,如有侵权请联系删除,转载需授权。













