
与正常组织相比,肿瘤表现出增强子重编程。超级增强子(Super enhancer, SE)是一类具有超强转录激活特性的顺式调控元件。近年来,分析SE图谱已成为发现癌症中新靶基因的有力工具,特别是在那些很少有复发突变基因的癌症中。癌症细胞系的增强子已被观察到与它们的癌症对应体不同,这表明细胞外部微环境对表观遗传的影响可能有助于肿瘤细胞的发育和生长。目前,SE重编程在癌症中发生的机制尚不完全清楚。
近日,来自美国西奈山伊坎医学院的研究团队首次发现结直肠癌(CRC)微环境可能能够对SE进行重新编程,激活结直肠上皮细胞中的PDZK1IP1基因。PDZK1IP1作为肿瘤生长的致癌驱动基因,与疾病的遗传驱动基因协作。研究团队认为减少炎症,降低PDZK1IP1表达水平的靶向治疗可能对CRC患者有益处。相关研究结果已发表Nature Communications上,文章题为“A local tumor microenvironment acquired super-enhancer induces an oncogenic driver in colorectal carcinoma”。

CRC是胃肠道中常见的恶性肿瘤,其发病率和病死率在消化系统恶性肿瘤中仅次于胃癌、食管癌和原发性肝癌。研究团队使用H3K27ac染色质免疫沉淀和ChIP-Seq测序对15例CRC患者的SE进行了测序,目的是利用调控异常的SE来识别CRC中的依赖基因(图1)。
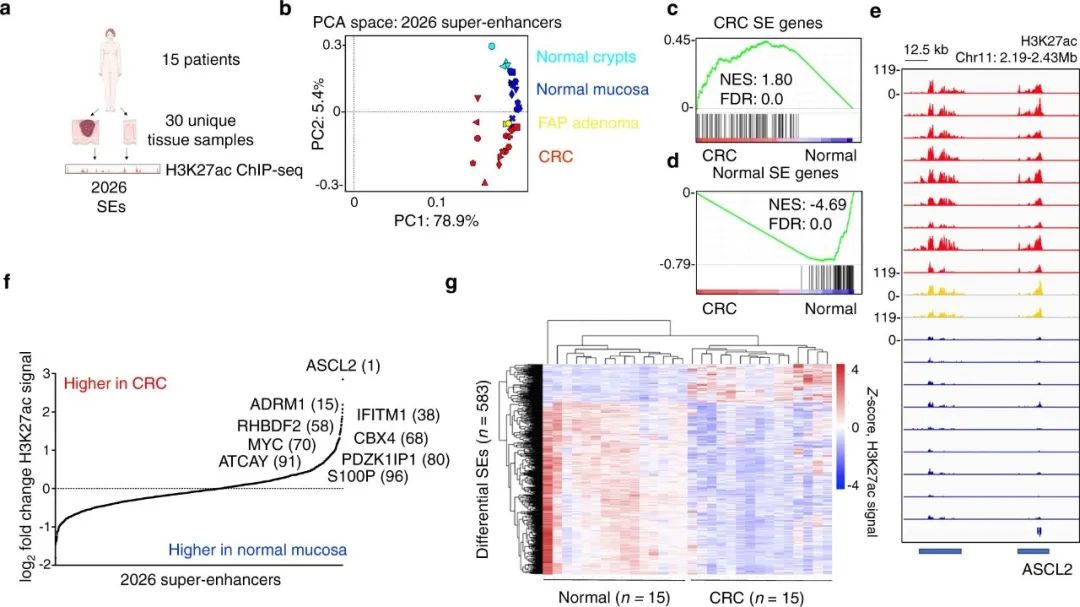
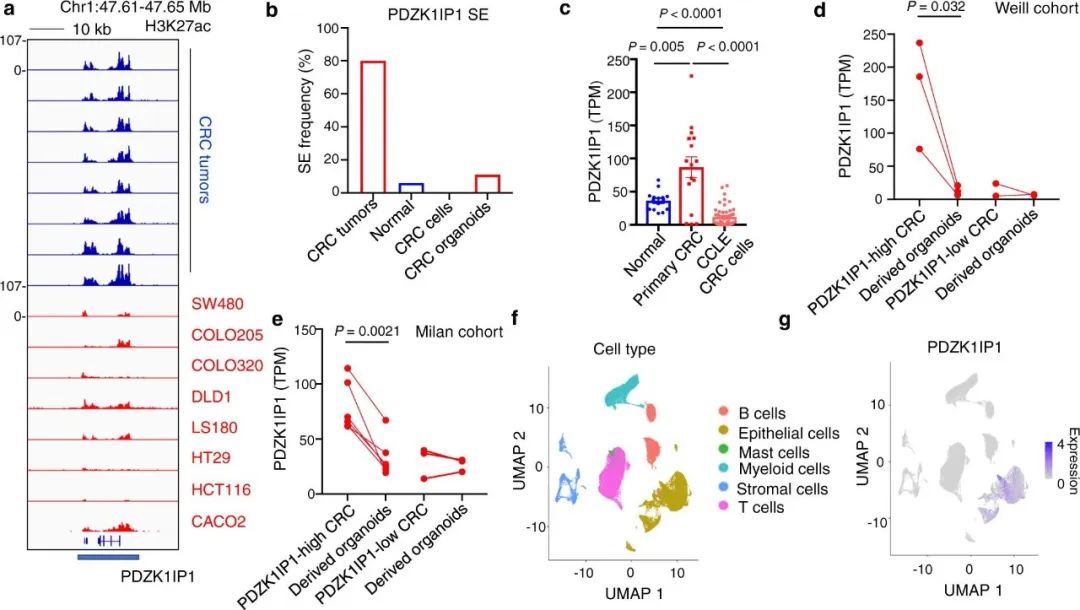
研究发现,在原发肿瘤样本富集的前100个SE中,有9个出现在与患者匹配的正常结肠中。其中,与PDZK1IP1基因相关的一种SE,在CRC复发相关的2026种SE中排第二。此外,在15个原发性CRC肿瘤中有12个满足ROSE标准的SE,在15个患者匹配的正常结肠上皮中有1个,在13个CRC细胞系中有0个(图2)。验证数据显示,在正常结直肠和CRC中,PDZK1IP1 SE上H3K27ac信号富集。
为了证明PDZK1IP1 SE受肿瘤微环境的影响,研究团队在裸鼠皮下异种移植了表达低水平PDZK1IP1的CRC细胞系—HT29(图3)。值得注意的是,研究人员发现在三个独立的异种移植瘤中的PDZK1IP1位点上,H3K27ac沉积增加,在体外培养的亲代细胞中没有。虽然使用的H3K27ac抗体对人类和小鼠都有反应,但ChIP-Seq测序的reads仅映射到人类基因组,以特异性捕获异种移植中人类CRC细胞的信号。总的来说,HT29异种移植未能恢复细胞系中其他表达不足基因位点的SE表达,包括IFITM1位点。
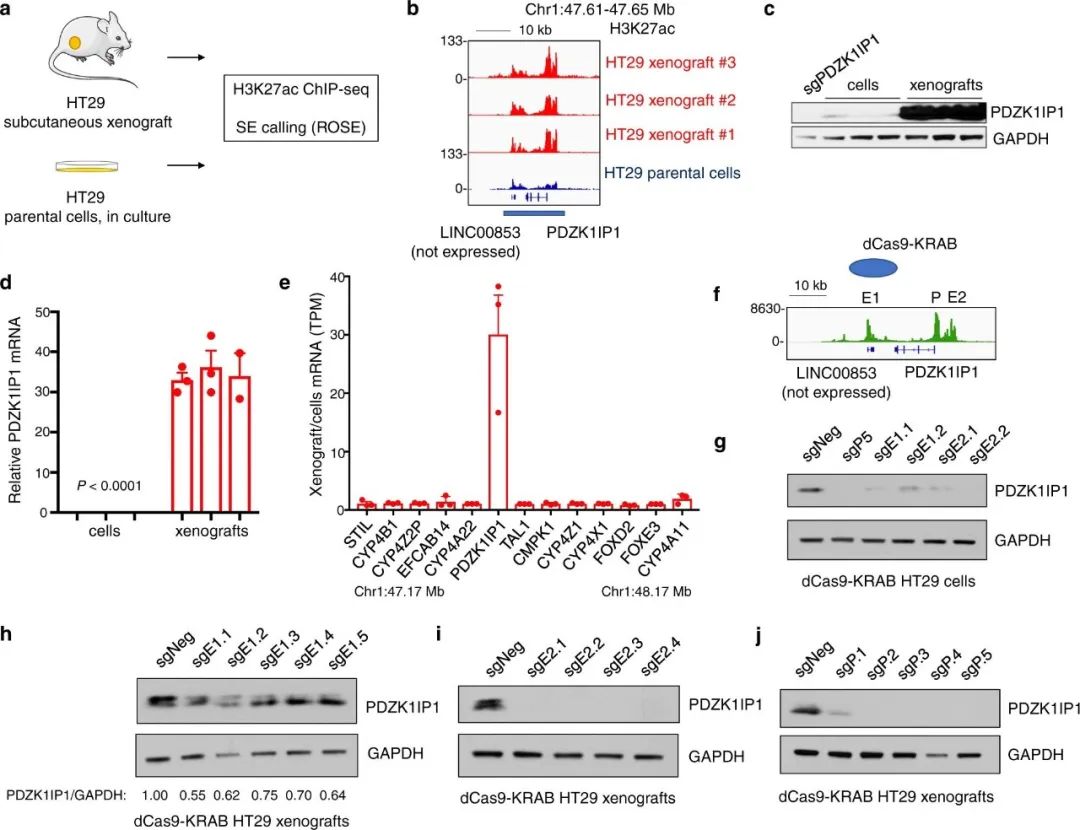
图3.异种移植修复PDZK1IP1超级增强子和CRISPR干扰减弱表达。
为了更好地理解PDZK1IP1微环境的表观遗传调控,研究团队分析了TCGA21的肿瘤ATAC-Seq和RNA-Seq数据集,发现了几个丰富的炎症转录因子(TF)基序,包括NF-κB、STAT1和STAT3,以及PDZK1IP1启动子和SE中开放染色质上的CTCF(图4)。
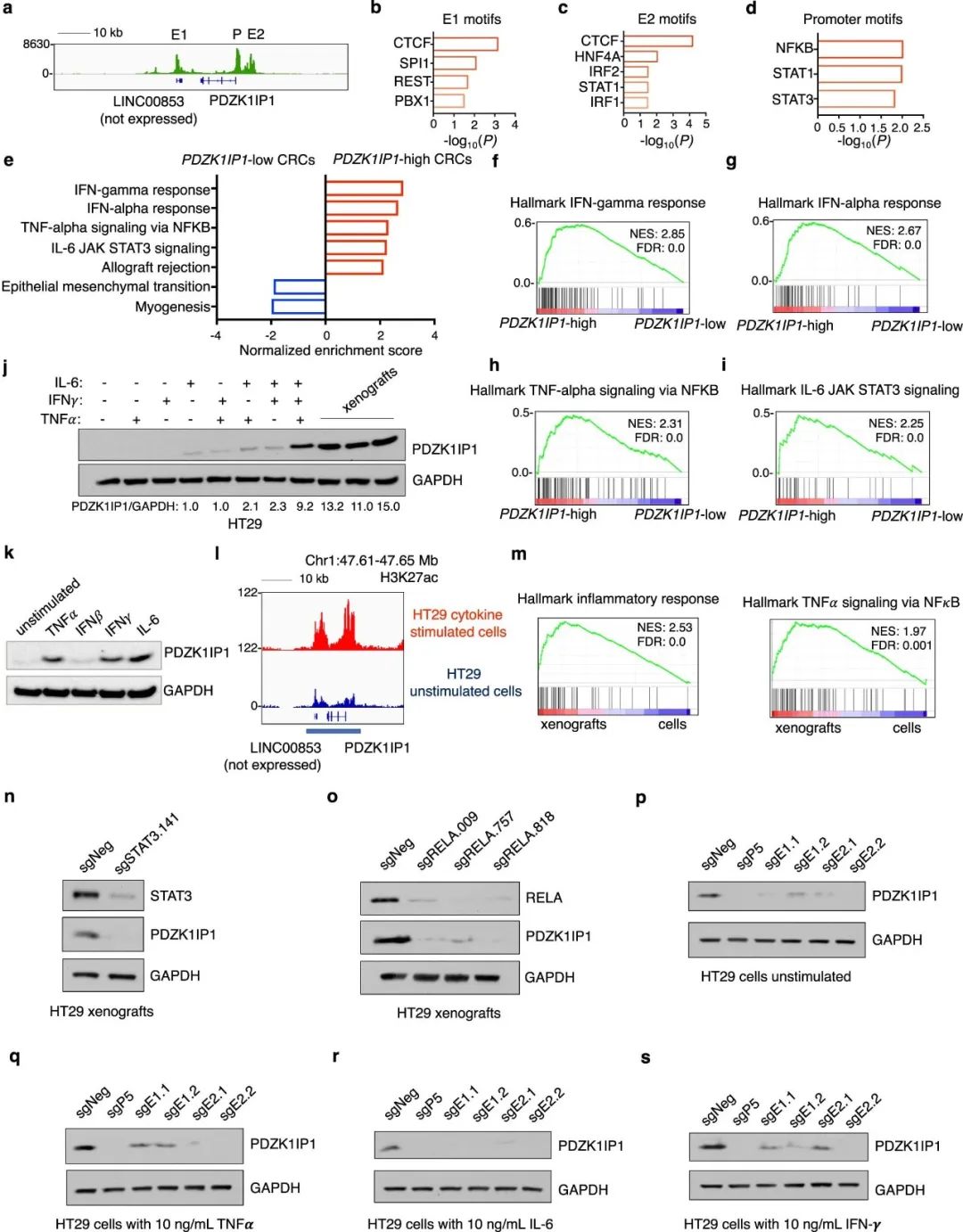
综上所述,该研究拓宽了对超级增强子的了解,并强调了原发性肿瘤样本和匹配对照的表观基因组分析的重要性。研究显示通过减少炎症,降低PDZK1IP1表达水平的靶向治疗可能对结直肠癌患者有好处,进一步支持了评估和验证肿瘤富集超级增强子以识别新的靶基因的需要。PDZK1IP1赋予了肿瘤细胞在肿瘤微环境中的生长优势,揭示了PDZK1IP1 SE激活和PDZK1IP1与CRC发展的相关性之间的联系。对局部微环境因子和上游细胞内信号的更深入的了解,扩大了抑制细胞外源性增强子和控制体内转录依赖性超级增强子的治疗策略的范围。
Zhou, R.W., Xu, J., Martin, T.C. et al. A local tumor microenvironment acquired super-enhancer induces an oncogenic driver in colorectal carcinoma. Nat Commun 13, 6041 (2022). https://doi.org/10.1038/s41467-022-33377-8
声明:本文来源测序中国,仅为交流学习。内容仅代表作者个人观点,望大家理性判断及应用。



















