
在全世界范围内,乳腺癌是最常见的恶性肿瘤,约占女性恶性肿瘤的30%,死亡率与发病率 之比为15%[1]。自从乳腺癌的分子特征,包括免疫组织化学标志物,如雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)和Ki-67增殖指数;基因组标志物,如BRCA1、BRCA2和PIK3CA;以及免疫学标志物,如肿瘤浸润淋巴细胞和程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1),被广泛描述以来,人们看待乳腺癌的方式已经发生了巨大的变化[2]。近年来,随着分子生物学技术以及“组学”知识体系的迅速扩大,恶性肿瘤的分子多样性和复杂性正在被逐渐揭示[3] ,治疗方式也从以肿瘤类型为导向转向以基因为导向,即根据生物标志物分析为患者进行个体化治疗[4],尤其是对于具有极其复杂且个体独特基因改变的转移性癌症[3,5],以基因为导向的精准治疗更是给患者带来了新的希望。从患者获得的肿瘤分子图谱可以优化癌症个性化治疗方案的选择,以及显著改善对治疗反应、耐药及肿瘤复发的监测[6],恶性肿瘤的治疗已经进入精准医学时代。
液体活检即通过对体液中肿瘤衍生材料所包含的基因组、蛋白质组等数据进行分析,可以获得并纵向实时监测关于个体患者肿瘤特征的详细信息,如肿瘤基因突变、表观遗传学改变等,为基于精准医学的治疗开辟新思路。本文将简要介绍液体活检中研究较为广泛的两种肿瘤衍生材料——循环肿瘤细胞(circulating tumor cell,CTC)和循环肿瘤DNA(circulating tumor DNA,ctDNA),就近年来CTC及ctDNA在乳腺 癌精准治疗中的应用研究进展进行综述,并对未来的发展趋势予以展望。
1
液体活检概述
液体活检,即从患者的血液、尿液、唾液、粪便、脑脊液等体液中分离获得肿瘤DNA、RNA、肿瘤细胞或细胞外囊泡等肿瘤衍生材料的过程[7],通过进一步分析可以获得肿瘤基因突 变、关键基因的拷贝数改变、蛋白质组学、表观遗传学改变等信息。相较于传统活检,液体活检在克服肿瘤异质性、克隆变异,以及连续采样等方面具有显著优势,使得在整个治疗过程中实时反映肿瘤分子图谱、纵向监测肿瘤反应和复发等变得可行。既往研究显示,液体活检在乳腺癌早期分子诊断、制订个性化治疗方案、评估治疗效果、预测预后等方面均可能发挥作用[8]。
1.1 液体活检中的循环肿瘤细
CTC是主动或被动从原发和(或)转移部位肿瘤中脱落进入人体循环的肿瘤细胞[6]。它们 在血液中的数量相当少,每百万个白细胞中几乎仅有一个CTC[9],且在外周血中的半衰期非常 短(1.0~2.4 h)[10],这决定了CTC分离技术的高难度及高挑战性。
许多技术已经被开发用于从液体标本中检测存活的CTC,以获得关于肿瘤的信息。这些技术主要基于以下几种原理:
① 基于免疫磁珠的CTC分离技术。如EPISPOT,使用针对存在于肿瘤细胞上的上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)的膜结合抗体,并随后在体外或体内条件下进行扩增;CellSearch,使用抗体标记的磁珠富集具有上皮细胞系标志物(如EpCAM)的CTC,但其局限性在于并不是所有的CTC都带有EpCAM[11];AdnaTest,在CellSearch的基础上还包括聚合酶链式反应(polymerase chain reaction,PCR)步骤来检测肿瘤细胞的mRNA;CTC CHIP,它包含数千个标记抗体的小微柱,已经被用来从血液样本中捕获携带特定肿瘤抗原的CTC[12]。② 基于负耗尽的CTC分离技术:其原理为利用针对除CTC外细胞(如白细胞、红细胞、血小板等)的反染色标志物,将它们从液体活检样本中耗尽,从而CTC得以从血液样本中浓缩,如EasySep Depletion Kit、RosetteSep, 其局限性在于其他血液成分与CTC之间可能存在交叉,在大量白细胞下拉中有CTC丢失的风险[13]。③ 基于细胞大小的CTC分离技术:其中尺寸放大技术通过使用标记有抗EpCAM抗体的微珠来人为增加CTC的尺寸,克服由于CTC的大小几乎与白细胞相同所致CTC损失的限制,从而提高细胞回收率和纯度;CELE系统则可以同时利用尺寸及变形性差异(CTC比白细胞更容易变形)来分离和分析CTC,相较于CellSearch系统有更高的灵敏度。④ 基于表面电荷及极化率差异的CTC分离技术:ApoStreamTM,相较于CellSearch系统同样被证明可以提高CTC的检测和回收[14]。
1.2 液体活检中的循环肿瘤DNA
ctDNA只占循环中细胞游离DNA(cell-free DNA,cfDNA)的0.1%~10.0%,而cfDNA正常血浆水平仅为10~100 ng/mL[15],因此ctDNA在癌症患者外周血中的含量也是相当低的。此外, ctDNA片段相较于cfDNA更短,为20~50个碱基对[16]。血浆中的ctDNA水平随肿瘤负荷、分期 和治疗反应而变化[17],与CTC不同,ctDNA被认为是指示肿瘤负荷的生物标志物[18-19]。除了 定量外,ctDNA在精准医学中的临床应用还体现在可以分析血浆中的ctDNA变异。
与分离和分析极低水平的ctDNA相关的限制在很大程度上已经被不断发展的技术应用所减少[20-21],但样品处理、ctDNA分离和分析方法尚未完全标准化。ctDNA的分析主要包括以下两类方法:① 靶向方法:专注于特定基因组区域中的特定基因重排或基因突变,而这些基因重排或基因突变是该类型肿瘤中常见的变异(如乳腺癌中的TP53、PI3KCA、GAB2、IRS2等)。包括基于PCR的液滴数字聚合酶链式反应(droplet digital polymerase chain reaction,ddPCR)、光束法(BEAMing)、个性化重排末端分析(personalized analysis of rearranged ends,PARE)等,以及基于二代测序( next generation sequencing,NGS)的标记扩增深度测序(tagged-amplicon deep sequencing,Tam-Seq)等方法。这些方法在多种肿瘤中显示出很高的灵敏度和特异度[22-25]。② 非靶向方法:与靶向方法不同,非靶向方法对血浆ctDNA进行全基因组图谱分析,因此获得的肿瘤基因组信息相对更全面。如大规模平行测序、高通量IlluminationsMiseq等。血浆ctDNA全基因组分析在多种肿瘤中被证实可以获得关于肿瘤基因突变、拷贝数改变,以及染色体重排等信息[26-27]。
2
液体活检在乳腺癌精准治疗中的应用研究进展
液体活检在乳腺癌精准治疗中的研究包括预测生存预后、检测微小残留疾病(minimal residual disease,MRD)、监测治疗效果,以及指导治疗方案的选择等,以下将从该4个方面对 近年来的研究进展简要叙述。
2.1 预测生存预后
对于早期乳腺癌,一项前瞻性研究发现在接受手术及辅助化疗前具有1个或更多CTC的Ⅰ~Ⅲ 期乳腺癌患者的无进展生存期(progression-free survival,PFS)和总生存期(overall survival, OS)显著缩短[28]。2016年的一项meta分析也提示在原发性乳腺癌患者中,CTC的存在是无病生存期(disease-free survival,DFS)、OS、乳腺癌特异性生存期(breast cancer-specific survival,BCSS)和远处无病生存期(distant disease-free survival,DDFS)的一个独立预测因子[29]。除了CTC数目,CTC中表观遗传学改变也可以预测预后,在Chimonidou等[30]从乳腺癌患者血液分 离的EpCAM+CTC中,肿瘤/转移抑制基因(如SOX17、BRMS1和CST6)启动子区的表观遗传学改变,如DNA甲基化,与肿瘤转移增强和预后不良相关。另外,在影像学的基础上,血液中的CTC水平还能提供额外的预后信息[31]。既往研究显示,ctDNA的检测同样与转移复发风险的增加相关,本团队的一项研究发现新辅助化疗开始前基线ctDNA阳性与较短的DFS和OS相关,特别是在激素受体阴性患者中[32]。PEARLYⅢ期临床试验纳入465例Ⅱ~Ⅲ期TNBC患者,中位随访16.8个月,在新辅助化疗之前进行ctDNA 拷贝数变异(copy number aberration,CNA)负荷检测,并分析其预后价值。发现新辅助化疗前基线ctDNA能够预测Ⅱ~Ⅲ期TNBC患者的复发风险,并且ctDNAⅠ-score独立于病理学完全缓解(pathological complete response,pCR)状态显示出预后价值,这提示基线ctDNA可作为TNBC患者升级或降级(新)辅助治疗策略的有效临床决定因素[33]。其他类似研究显示,新辅助治疗1个周期后ctDNA阳性与较短的DFS和OS 相关[34]。Magbanua等[35]发现对于高危早期乳腺癌患者,新辅助治疗期间或结束后ctDNA未清除是反应不佳和远处复发的重要预测因素,而ctDNA清除[即使未达到病理学完全缓解(non-pathological complete response,non-pCR)]则与较好的生存率相关,新辅助治疗期间对ctDNA 进行个性化监测可能有助于实时评估治疗反应,并有助于调整pCR作为生存的替代终点。2022年的一项meta分析报道基线及新辅助治疗结束后ctDNA的存在与较差的无复发生存(recurrence-free survival,RFS)及OS相关[36]。除此之外,术后ctDNA监测同样能够准确区分有远处复发和无远处复发的患者(灵敏度为93%,特异度为100%)[36],并且比临床诊断疾病复发平均早数月[37-38]。
对于晚期乳腺癌,现有研究已证实在接受全身治疗前外周血中CTC的数量是转移性乳腺癌PFS和OS的独立预测因子[39],基线CTC水平高与较差的PFS及OS相关[40-41],并且在全身治疗期间任何时候CTC数量增加(≥5 vs <5)与转移性乳腺癌患者较差的PFS和OS相关[42]。与CTC相似,ctDNA水平与进展期乳腺癌生存结果密切相关[40,43]。除了ctDNA水平,ctDNA中遗传改变的数量(<2 vs ≥2)也被发现对PFS和OS有影响[40]。除此之外,CTC及ctDNA在治疗前后的动态变化与生存结果显著相关,既往研究显示,在转移性乳腺癌患者中,治疗后CTC计数的增加与PFS和OS缩短相关,当添加至完整的临床病理学预测模型中时,CTC计数还可以提高对转移 性乳腺癌预后的预测价值[41]。O’Leary等[44]发现,哌柏西利联合氟维司群治疗15 d后,PIK3CA突变ctDNA水平的相对变化对PFS有很强的预测作用,CDR15[治疗第15天ctDNA突变丰度(突变拷贝数/mL)相对于基线的比率]中位数水平 以下患者的PFS显著延长。因此,可以预见,液体活检有可能发展成为预测乳腺癌患者生存的早期替代终点。
2.2 检测MRD
在完成治愈性治疗的早期癌症患者中,相当一部分体内仍存在MRD,这些病灶在最初局部和全身治疗后持续存在,成为远处转移复发的潜在来源,尤其是激素受体阳性的乳腺癌,这是与晚期复发有关的典型癌症[45]。相较于出现临床复发后给予解救治疗,及时发现MRD可以极大地帮助预防复发和增加这些患者的治愈机会,这可能是由于微转移患者肿瘤负荷低,且MRD 可能会随着时间的推移而出现克隆演变导致肿瘤内部高度异质性[46]。MRD检测已广泛用于血液系统恶性肿瘤患者[47-48],但对于实体肿瘤患 者,治愈性治疗后患者体内ctDNA和CTC远低于已确诊转移的患者,因此需要使用超灵敏检测技术,受上述因素的限制,MRD检测仍然具有挑战性。然而,近年来随着液体活检技术尤其是ctDNA的发展,实体肿瘤MRD检测变得可行并在许多实体肿瘤中被报道[49-52]。
ctDNA和CTC在外周血中的典型转运时间在数小时范围内[53],因此,在治愈性治疗数月或数年后检测到ctDNA和(或)CTC表明MRD的持续存在。既往研究显示,高危乳腺癌患者化疗结束后2年CTC阳性状态预示着较短的DFS 和OS[54]。2018年,Sparano等[55]发现在确诊后至5年内出现CTC可以预测可手术的激素受体阳性HER2-乳腺癌患者的晚期复发,在激素受体阳性的353例患者中,CTC阳性组的年复发率为21.4%,而CTC阴性组仅为2.0%,并且在多因素分析中,CTC检测结果阳性将使复发风险增加13.1倍。多项小型研究表明,手术或完成标准全身系统治疗后ctDNA-MRD(基于ctDNA的微小残留疾病)阳性患者预后差,是复发的高风险群体。Olsson等[24]发现新辅助治疗和术后ctDNA监测可用于评估MRD及复发风险,其灵敏度和特异度分别达到93%、100%,在86%的患者中,基于ctDNA的检测先于临床检测转移,平均提前时间为11个月。Garcia-Murillas等[37]也发现,在完成治愈性治疗后检测血浆中的ctDNA可以高度准确地预测转移复发,而序列样本中的突变跟踪可以增加预测复发的灵敏度,相较于临床复发中位提前时间为7.9个月。2019年Garcia-Murillas等[56]前瞻性使用个性化的肿瘤特异性PCR,监测接受手术及全身系统治疗后患者外周血中的ctDNA,在随访的第一年每3个月采集1次,随后每6个月采集1次,发现与临床复发相比,ctDNA检测到复发的中位时间提前10.7个月(95% CI:8.1~19.1 个月),并且与所有乳腺癌亚型相关。此外,一项基于83例确诊5年以上临床明确无复发的高危激素受体阳性/HER2-乳腺癌患者的前瞻性研究,中位随访8.4年,所有发生远处转移的6例患者均可在外周血中检测到ctDNA,且相较于临床复发中位时间提前达1年[57]。另外一项研究对纳入156例乳腺癌患者的1 141个术后监测血液样本进行了回顾性分析,结果发现ctDNA检测阳性的患者手术后RFS较差(HR = 47.50;95% CI:18.5~161.4;P<0.001),且术后连续监测ctDNA可相较于临床显著提前预测转移性复发(中位10个月,范围:0~39个月),其中激素受体阳性/HER2-亚型提前预测复发中位数为15个月(范围:2~39个月)、TNBC亚型为9个月(范围:0~20个月)、激素受体阳性/HER2+亚型为8个月(范围:5~14个月)、HR-/HER2+亚型为6个月(范围:0.5~12个月)[58]。因此,外周血ctDNA与早期乳腺癌未来复发高风险相关,更重要的是,早期发现转移性复发为治疗干预提供了可能的窗口期,但仍需要前瞻性研究来评估分子复发检测指导辅助治疗的潜力。
2.3 监测治疗效果
液体活检作为一种相对无创的活检方法,在治疗期间易于获得连续的血液样本,尤其是当肿瘤转移至传统活检难以取样的部位(如肺或脑等),更加体现出液体活检的优势。既往研究报道,无论是早期乳腺癌的新辅助治疗、辅助治疗,还是转移性乳腺癌的解救治疗,液体活检都可以用于纵向监测治疗效果,进而指导临床决策。
2.3.1 新辅助治疗
本团队使用覆盖1 021个基因的大型面板,纵向监测接受新辅助治疗的早期乳腺癌患者外周血中的ctDNA,发现在新辅助治疗2个周期及新辅助治疗结束后ctDNA的水平与肿瘤应答显著相关,并且新辅助治疗2个周期后ctDNA水平的变化预测局部肿瘤对治疗的反应比超声检查更好[32]。2021年Magbanua等[35]使用包含16个左右突变基因的个性化面板,监测新辅助治疗期间患者外周血ctDNA的动态变化,发现ctDNA的清除与肿瘤对治疗的反应相关,早期(1个周期后)清除相较于早期未清除患者的pCR率高,而越后期未清除对non-pCR的阳性预测值越高。另外一项研究纳入了ABCSG-34试验招募的187例患者(其中127例为激素受体阳性,57例为TNBC),回顾性分析了患者新辅助系统治疗(neoadjuvant systemic treatment,NST)期间381例血液样本,发现在NST中期检测和持续存在ctDNA有可能负面预测对NST的反应,并识别无法达到pCR或将被归类为残留肿瘤负荷(residual cancer burden,RCB)Ⅱ/Ⅲ的患者,提示pCR或RCB的无创鉴定在未来可能有助于临床决策,进一步提高患者获益[59]。除此之外,甲基化RASSF1同样与新辅助治疗反应(降低 vs 不降低)及预测复发相关(随访3~33个月);而甲基化基因清除与pCR显著相关[60]。因此,在新辅助治疗期间监测ctDNA可能有助于实时评估治疗反应及疗效。
2.3.2 辅助及解救治疗
在HER2阴性的早期乳腺癌患者中,手术和(新)辅助化疗后使用曲妥珠单抗治疗并不会降低CTC检出率[61],而既往的一项大型随机试验恰好显示与在该患者群体中曲妥珠单抗疗效为阴性结果[62]。在接受化疗或内分泌治疗的转移性乳腺癌患者中,CTC计数与影像学疾病进展之间存在强相关性,并且这种相关性适用于成像时(优势比OR=6.3)、成像前3~5周(OR=3.1)和成像前7~9周(OR=4.9)的CTC结果,这表明CTC可用于实时监测治疗反应,并在必要时迅速改变治疗方案[63]。而Dawson等[64]研究发现,在接受全身治疗的晚期乳腺癌患者中,与CA153或CTC相比,ctDNA水平显示出更大的动态范围,以及与肿瘤负荷变化更显著的相关性。并且19例患者中的10例(53%)在影像学确定疾病进展前平均5个月,ctDNA水平在一个或多个连续时间点增加,这提示ctDNA可能是监测治疗反应更敏感的生物标志物。
2.4 指导治疗方案的选择
通过采集患者的外周血进行CTC和(或)ctDNA分析,可能检测出具有遗传和(或)表观遗传学变异的患者群体,这些变异可能是特定药物的治疗或耐药靶点;另外,液体活检有助于以“实时”方式检测肿瘤相关基因的不断演变,这有助于选择并及时更换更有效的治疗方案。尤其是对于转移性乳腺癌的患者,每个患有转移性癌症的患者都有一组复杂的、往往是独特的基因组异常[3,5],因此,为了精确地靶向恶性肿瘤, 治疗更加需要个性化。
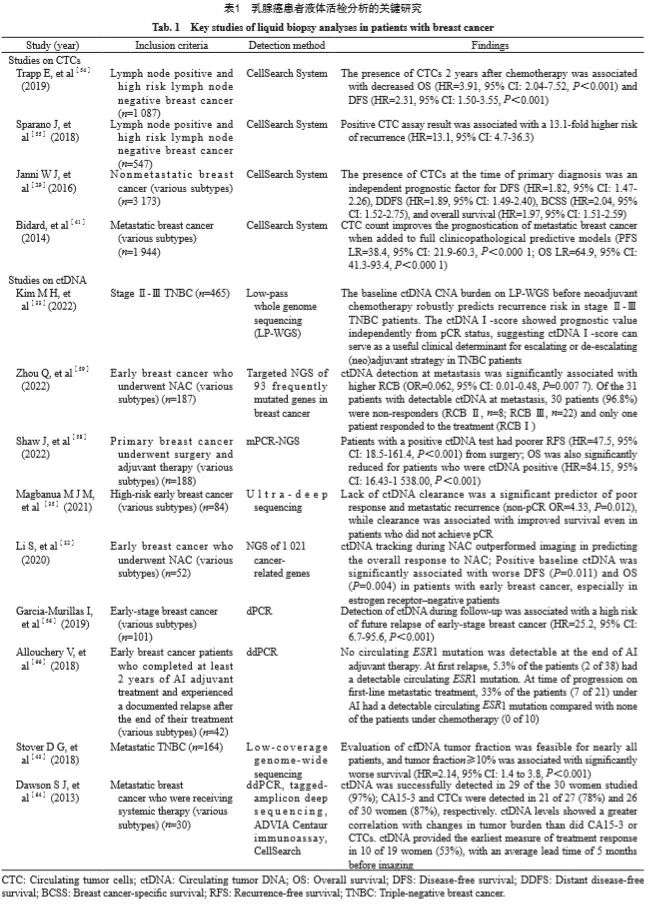
利用CellSearch系统针对ER、B细胞淋巴瘤/白血病-2基因(B cell lymphoma/leukemia-2 gene,BCL2)、人表皮生长因子受体2(epidermal growth factor receptor 2,EGFR2)和Ki-67增殖指数等标志物分离的CTC所开发的新型CTC内分泌治疗指数,是预测乳腺癌患者内分泌治疗反应的重要参数[65]。既往有研究显示,芳香化酶抑制剂(aromatase inhibitor,AI)可能诱导ESR1基因突变[66-67],ctDNA中ESR1突变阳性的晚期乳腺癌患者对依西美坦的反应不佳,与内分泌耐药及疾病进展相关[66],而在将药物方案从依西美坦改为氟维司群(ER下调剂)或在依西美坦中加入依维莫司(mTOR抑制剂)后,PFS有所改善[68]。另外,CTC中ESR1甲基化改变则与对依维莫司/依西美坦方案无反应有关[69]。除此之外,ctDNA中的ESR1突变可以在临床进展前的6、7个月被检测到,这为早期治疗干预提供了充足的机会[70]。O’Leary等[44]研究发现,在接受哌柏西利与氟维司群联合治疗的激素受体阳性晚期乳腺癌患者中,当在血浆中跟踪PIK3CA主干突变时,PIK3CA突变ctDNA水平的早期相对变化预测长期生存结果的时间远远早于肿瘤大小的变化,在治疗第15天通过检测ctDNA突变丰度即可对治疗反应进行个体化早期评估,这为临床治疗方案的选择和更换提供指导。Arpino等[71]发现结合ctDNA和胸苷激酶1活性(thymidine kinase 1 activity,TKa)两种生物标志物的早期动态评估可能会改善RIB+LET(瑞博西尼+来曲唑)联合治疗的疗效预测,在治疗无效患者中,高度呈现出ctDNA+/TKa+。且仅需两周的时间,即可以区分对治疗有效和无效的患者。这种通过极小创伤、不需要组织穿刺来早期预测内分泌治疗效果的方法具有良好的应用前景。乳腺癌患者液体活检分析的关键研究见表1。
3
总结及未来展望
在过去的5年里,随着NGS、ddPCR等技术的发展,液体活检在临床上的潜在应用得到了广泛的研究,在乳腺癌的精准治疗中显示出巨大的潜力。它可以监测对不同治疗方案的反应,并且是比影像学更敏感的生物标志物,CTC和ctDNA能够在影像学改变出现之前的几个月预测疾病进展,可以帮助临床医师在必要时及时改变治疗方案,防止疾病复发或进展。液体活检还可以用于检测完成手术和(新)辅助治疗后体内是否有微小残留疾病,及时发现MRD可以极大地帮助预防复发和增加这些患者的治愈机会。此外,ctDNA的分子图谱比原发肿瘤更能反映复发/转移疾病,因此ctDNA测序也可以为后续治疗提供更好的指导。
对于使用内分泌治疗的乳腺癌患者,ctDNA 检测有助于识别对AI等疗法产生耐药的突变和(或)表观遗传学改变,这有助于在疾病进展之前尽早改变治疗方案。
虽然液体活检在乳腺癌精准治疗方面的研究取得了令人瞩目的进展,但是仍存在一些问题。譬如多数患者队列相当小(尤其是ctDNA分析,很多研究中评估的患者数量<50例),需要在更大的前瞻性临床试验中进一步验证这些发现;此外,在分离和分析血液中肿瘤衍生物方面,还需要更多的工作来进一步改进技术,并在目前众多的技术和检测程序中,确定最优的检测策略,为其在临床上的使用建立标准化方案。
相信随着时间的推移,液体活检将在乳腺癌临床实践中发挥更大的作用。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
声明:本文来源中国癌症杂志,仅为交流学习。内容仅代表作者个人观点,望大家理性判断及应用。













