
在我国,心脑血管疾病(CVD)已成为我国居民的第一死因,占总死亡人数的40%以上,而且患病率和死亡率仍处在不断攀升的阶段。血脂作为导致心血管疾病的重要危险因素之一,血脂异常的防治是降低CVD风险的关键。这也是为什么很多体检项目中加入血脂检测的原因。
临床上血脂化验检查繁多,不同医院开展的情况也不同,从最基础的血脂四项,到现在常见的血脂五项、血脂七项,主要是检测总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)、载脂蛋白A1(Apo AI)、载脂蛋白B(ApoB)。
近年来,脂蛋白(a)[Lp(a)] 便是近年来证据较多且备受关注的血脂干预潜在新靶点之一,其中美国国家胆固醇教育计划成人治疗指南中,脂蛋白(a)被归为“新兴的”脂类危险因素。
血脂检查:
1. 总胆固醇(TC)
指血液中各种脂蛋白所含胆固醇之总和,受年龄、性别、饮食、遗传因素影响,用于对动脉粥样硬化性疾病的危险评估和预测。
2. 低密度脂蛋白胆固醇(LDL-C)
LDL~C增高是动脉粥样硬化发生、发展的主要危险因素,影响TC的因素均可同样影响LDL~C水平。常采用LDL-C作为ASCVD危险性的评估指标。
3. 高密度脂蛋白胆固醇(HDL-C)
HDL参与胆固醇逆转运,可减少胆固醇在血管壁的沉积,起到抗动脉粥样硬化作用,大量的流行病学资料表明,血清HDL-C水平与ASCVD发病危险呈负相关。
4. 甘油三酯
受遗传和环境因素的双重影响,与种族、年龄、性别以及生活习惯(如饮食、运动等)有关,个体差异大,血清TG水平轻至中度升高者患冠心病危险性增加。当TG重度升高时,常可伴发急性胰腺炎。
5. 极低密度脂蛋白胆固醇(VLDL-C)
VLDL富含甘油三酯,有研究表明VLDL-C升高与动脉粥样硬化疾病相关。
6. 载脂蛋白A1(ApoA1)
HDL颗粒的重要组成部分,血清ApoA1可以反映HDL水平,与HDL~C水平呈明显正相关,其临床意义也大体相似。
7. 载脂蛋白B(ApoB)
临床常规测定的Ap0B通常指的是ApoB100,大约90%的ApoB分布在LDL中,与血清LDL~C水平呈明显正相关,两者的临床意义相似。
8. 脂蛋白(a)[Lp(a)]
新检测指标,主要与遗传有关,基本不受性别、年龄等因素影响,被认为是ASCVD的独立危险因素。
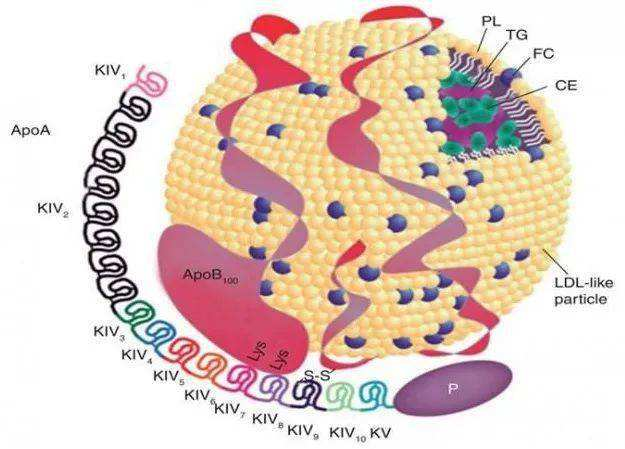
脂蛋白(a):
1963年,瑞典的遗传学家Berg在分析兔抗血清与人血清的反应时发现了一种与低密度脂蛋白胆固醇 (Low Density Lipoprotein-Cholesterol, LDL-C)相似的脂蛋白颗粒。在进行蛋白电泳时,该条带位于β脂蛋白(LDL-C)和前β脂蛋白(极低密度脂蛋白Very Low Density Lipoprotein-Cholesterol, VLDL-C)之间,Berg将其命名为Lp(a)。在早期,受限于检测手段,并不是所有人的血清中都可以检测到Lp(a),Berg认为Lp(a)是LDL-C的一种遗传变异,Berg还计算了挪威人群的Lp(a)编码基因的“变异基因频率”为0.1881。
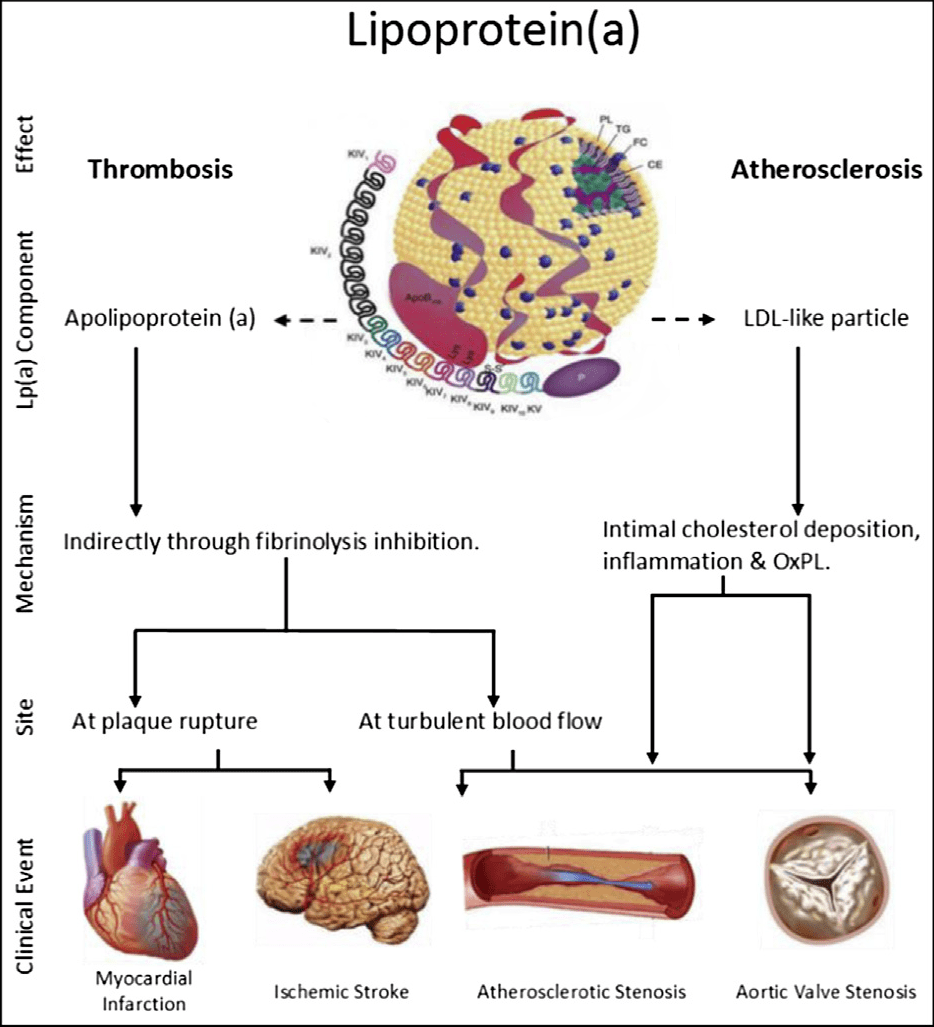
Lp(a)由低密度脂蛋白(LDL)样颗粒和载脂蛋白a[Apo(a)]组成,两者以二硫键共价结合。电镜下Lp(a)呈圆球型,直径约21 nm,密度约1.05~1.10g/ml。Lp(a)结构包括:LDL样颗粒约含有30%~46%的胆固醇及载脂蛋白B100(Apo B100)和氧化磷脂(OxPL)。Apo(a)是一种高度糖化的亲水蛋白质,占Lp(a)总量的25%~40%。Lp(a)具有显著的多态性,源于Apo(a)肽链长度不一。Apo(a)有10个同源的kringleⅣ(KⅣ)结构域,KⅣ第2个结构域中的相似环饼从2~40个拷贝数不等,其他均只有一个拷贝数,从而决定了Lp(a)的分子量大小及血浆Lp(a)水平在不同个体间存在较大差异。此外,Apo(a)的多态性还取决于其糖化程度。
Lp(a)比LDL更容易致动脉粥样硬化,且具有更长的血浆停留时间,但Lp(a)的生理作用尚未完全阐明。
对 Lp(a) 心血管风险的阈值,不同指南和共识推荐的并不一致:
1. 2010年欧洲动脉硬化学会(EAS)关于Lp(a)的专家共识指出,Lp(a)升高是明确的心血管疾病危险因素,其水平与CVD风险呈线性关系,没有明确的切点或阈值,理想的Lp(a)水平应在50 mg/dl以下。
2. 2016年加拿大血脂异常管理指南指出,Lp(a)水平>30 mg/dl是心血管疾病的危险因素。
3. 2016年欧洲心脏病学会(ESC)/EAS血脂管理指南指出,Lp(a)是ASCVD的独立危险因素,当Lp(a)大于第80百分位数(50 mg/dl)时,认为其风险有显著统计学意义。
4. 《中国成人血脂异常防治指南(2016年修订版)》指出,在排除各种应激性升高的情况下,Lp(a)被认为是ASCVD的独立危险因素,Lp(a)通常以30 mg/dl为切点,高于此水平者患冠心病的危险性明显增高。
5. 2018年美国心脏协会/美国心脏病学会(AHA/ACC)血脂异常管理指南指出,Lp(a)>50 mg/dl是ASCVD的独立危险因素。
6. 2019年美国国家脂质协会(NLA)关于Lp(a)的科学声明指出,Lp(a)是广泛被认可的ASCVD独立危险因素,Lp(a)50 mg/dl提示存在显著风险。
尽管较多使用的是 50 mg/dl,但综合中国人群证据,《专家科学建议》推荐 30 mg/dL 作为中国人群 Lp(a) 风险切点。
建议在以下五类人群中检测血清 Lp(a) 水平:
1. ASCVD 极高危人群;
2. 早发 ASCVD 家族史(男性 <55 岁,女性 < 65 岁);
3. 直系亲属血清 Lp(a) 水平升高 > 90 mg/dL(200 nmol/L);
4. 家族性高胆固醇血症(FH)或其他遗传性血脂异常;
5. 钙化性主动脉瓣狭窄(CAVS)患者。
基因组学、流行病学、孟德尔随机研究均显示,Lp(a) 升高是多种心血管疾病的独立危险因素,各大指南都推荐对 Lp(a) 进行筛查,在每个成年人的一生中至少应检测一次 Lp(a)。
治疗:
迄今尚缺乏有效降低Lp(a)水平的治疗方法,也无药物获批专用于降低Lp(a)。对于Lp(a)升高的患者,管理原则是:(1)降低总体ASCVD风险;(2)控制伴随的其他有临床意义的血脂异常。
生活方式干预:尽管健康饮食、运动等生活方式治疗无法直接降低Lp(a)水平,但是通过积极控制其他可改变的心血管危险因素,对于降低Lp(a)升高患者的总体心血管风险仍然具有十分重要的意义。
他汀治疗:积极降低LDL-C也可以降低Lp(a)升高带来的CVD风险[48,49]。2018年美国心脏病学会(ACC)/美国心脏协会(AHA)血脂指南建议[50]:在ASCVD中危人群(10年ASCVD风险7.5%~19.9%)的一级预防中,Lp(a)≥50 mg/dl或≥100 nmol/L是一个合理的风险增强因子,考虑启动中强度或高强度他汀类药物治疗是必要的。需要注意的是,即使将LDL-C控制在较低的水平,高Lp(a)患者的MACE风险仍然显著高于低Lp(a)的患者[51,52],提示Lp(a)水平升高带来的风险并不会因他汀等降脂药物的使用和LDL-C的达标而完全消除。
PCSK9抑制剂:现有数据显示,PCSK9单克隆抗体及靶向PCSK9信使RNA的小干扰RNA(siRNA)类药物可使Lp(a)水平降低约20%~30%。PCSK9抑制剂对LDL-C、Lp(a)、总胆固醇和ApoB均有影响,因而无法明确单独降低Lp(a)水平的获益,仍需要更多的研究和观察。专家组建议,对于Lp(a)≥30 mg/dl的ASCVD患者,应尽可能使用中等强度的最大可耐受他汀和依折麦布联合治疗使其LDL-C达标包括加用PCSK9抑制剂。但考虑药物经济学和现有证据,不论何种人群,本科学建议不推荐以降Lp(a)为首要目的应用PCSK9抑制剂。
脂蛋白置换术(LA):LA后即刻对于Lp(a)的降幅可达50%~70%,一周内的平均降幅约为30%~35%。HEART UK指南建议,对于已经采取最大程度降脂治疗仍有进行性CAD恶化,且Lp(a)>60 mg/dl,LDL-C仍在125 mg/dl(3.3 mmol/L)以上的患者,可考虑LA治疗。鉴于LA的局限性(操作复杂、有一定并发症风险,费效比低和国内能开展LA的中心非常有限等),不推荐LA常规用于治疗Lp(a)增高的患者。借鉴国外经验与建议,对于经充分降LDL-C治疗以及控制其他危险因素后,Lp(a)≥60 mg/dl,且动脉粥样硬化进行性加重的患者可采用“医生与患者沟通决策模式”酌情选用LA治疗。
参考文献:
[1] 脂蛋白(a)与心血管疾病风险关系及临床管理的专家科学建议[J].中国循环杂志,2021,36(12):1158-1167.
[2] 欧阳运峰,李皇庆,李璐,阳军.脂蛋白a:动脉粥样硬化性心血管疾病防治新靶点[J].心血管病学进展,2022,43(08).
[3] Kronenberg F, Mora S, Stroes E S G, et al. Lipoprotein (a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement[J]. European Heart Journal, 2022.
声明:本文为原创内容,作者陶宇,仅用于学习交流,转载需授权。













