
1 光动力疗法和抗肿瘤免疫
PDT诱导抗肿瘤免疫反应的最重要机制依赖于肿瘤抗原特异性T淋巴细胞的产生。在光动力治疗过程中释放的DAMPS影响下,吞噬肿瘤细胞碎片的树突状细胞被激活,变成熟并迁移到引流淋巴结,与幼稚的CD4+T细胞形成免疫突触。T细胞激活并显著增殖,识别和杀死携带同源抗原的肿瘤细胞。被激活的CD4+T细胞表型Th1高度促炎,分泌IL-12和IFNγ,激活CD8+T细胞。
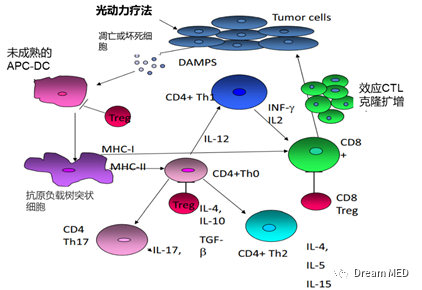
抗肿瘤免疫的诱导机制
1.1、PDT与中性粒细胞
PDT可导致循环中性粒细胞数量急剧增加及中性粒细胞浸润到治疗的肿瘤中,同时PDT介导的肿瘤微血管内皮细胞损伤可导致中性粒细胞粘附。
1.2、PDT与自然杀伤细胞
有研究表明PDT可以上调NK细胞识别的肿瘤细胞上特异性配体的表达,包括NKG2D、UL16结合蛋白和MHC1,从而提高NK细胞对肿瘤细胞的体外杀伤力。
1.3、PDT与巨噬细胞和树突状细胞
TAMS(肿瘤相关巨噬细胞), 可以抑制免疫系统的其他功能,产生细胞因子和生长因子,刺激肿瘤细胞生长,分泌促血管生成因子,降解细胞外基质,从而促进转移。Korbelik等人研究表明肿瘤内的TAMS积累了大量不同的PS(光敏剂),可能会增强PDT的肿瘤定位效应。PDT治疗后未成熟的DC吞噬肿瘤抗原,并在DAMPS的影响下成熟,然后迁移到引流淋巴结,将抗原呈递给幼稚的T细胞。
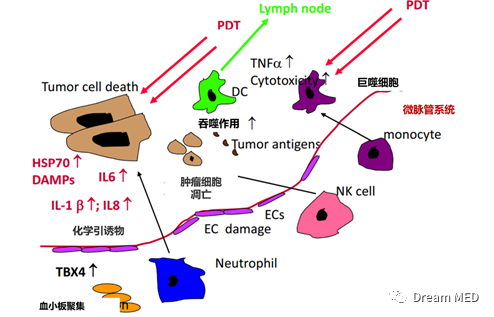
光动力疗法后免疫细胞的肿瘤浸润
2 光动力疗法与免疫检查点抑制剂潜在协同作用
多种因素可以促进PDT和免疫检查点抑制剂之间的协同作用。PDT可导致DAMPs和肿瘤抗原的释放,这对触发先天性免疫应答至关重要,可作为免疫治疗的良好辅助。此外,PDT可能改变肿瘤微环境中的免疫检查点活性,使该环境对免疫检查点抑制剂敏感。PDT可以引 起肿瘤微环境的变化,使PD-L1上调。PDT诱导的组织损伤产生IL6可以通过STAT3增强PD-1的表达,通过JAK1增强PD-L1的表达和稳定性。
3
临床应用
Santos等人报告了一项病例研究,一名62岁的局部晚期口腔底鳞状细胞癌患者,在手术、放疗和多种全身治疗后出现口腔处广泛的肿瘤进展后接受了Redaporfin介导的PDT和检查点抑制剂Nivolumab的联合治疗。共接受了33周期的Nivolumab治疗,疗效评价持续的完全临床缓解,无进展生存期19个月。PDT和ICI联合治疗,可成为治疗难治性头颈部鳞状细胞癌的新选择,改善预后并延长生存期。
4
总结
光动力疗法能够破坏原发肿瘤,在产生DAMP和促炎信号的情况下释放肿瘤抗原,改变肿瘤微环境,因此PDT与免疫治疗相结合可以成为抗肿瘤治疗的新选择。
参考文献
1、Hamblin MR, Abrahamse H. Factors Affecting Photodynamic Therapy andAnti-Tumor Immune Response. Anticancer Agents Med Chem. 2021;21(2):123-136.doi: 10.2174/1871520620666200318101037. PMID: 32188394.
2、Cramer GM, Moon EK, Cengel KA, Busch TM. Photodynamic Therapy andImmune Checkpoint Blockade†. Photochem Photobiol. 2020Sep;96(5):954-961. doi: 10.1111/php.13300. Epub 2020 Jul 14. PMID: 32573787.
3、Santos, L.L.; Oliveira, J.; Monteiro, E.; Santos, J.; Sarmento, C.Treatment of head and neck cancer with photodynamic therapy with redaporfin: Aclinical case report. Case Rep. Oncol., 2018, 11(3), 769-776.
声明:本文来源Dream MED,仅为交流学习。内容仅代表作者个人观点,望大家理性判断及应用。













