引用本文:中国康复医学会骨质疏松预防与康复专业委员会. 骨质疏松性骨折二级预防中国专家共识 [J] . 中华医学杂志, 2022, 102(45) : 3581-3591. DOI: 10.3760/cma.j.cn112137-20220923-02011.
通信作者:杨惠林,苏州大学附属第一医院骨科,苏州 215000,Email:suzhouspine@163.com.
摘要
随着人口老龄化,骨质疏松症日益成为社会公共问题,而骨折是骨质疏松症最严重的并发症。且骨质疏松性骨折发病率逐年上升,危害大,严重危及健康老龄化,但目前的诊疗现状仍有待改善。为促进骨质疏松性骨折的规范诊疗,优化其早期识别、诊断、治疗策略,并预防再骨折,提高骨质疏松性骨折患者及风险人群的生存质量和健康水平,由中国康复医学会骨质疏松预防与康复专业委员会牵头,通过改良Delphi法制定了本共识,供广大医务工作者参考。
2021年,联合国大会宣布2021年至2030年为“健康老龄化十年”,并将肌肉骨骼健康作为老年人健康状况的最重要指标之一。2022年9月20日,国家卫生健康委员会举行新闻发布会,谈及中国老龄化呈现的形势与特点,表示到2035年我国将进入重度老龄化阶段。截至2021年底,全国60岁及以上老年人口达2.67亿,占总人口的18.9%;65岁及以上老年人口达2亿以上,占总人口的14.2%。骨质疏松症是老年人肌肉骨骼系统疾病的典型代表,其危害最大的并发症就是骨折。骨质疏松性骨折又称脆性骨折,是指站立位或更低位置跌倒的低能量非暴力所导致的骨折[1-2]。
二级预防指在疾病的临床前期通过采取早期发现、早期诊断、早期治疗的“三早”预防措施,以控制疾病的发展和恶化[3]。而骨质疏松性骨折的二级预防是指针对患有骨质疏松症、具有骨质疏松性骨折高风险或既往发生过脆性骨折的人群,采用各种措施,早期识别、诊断、治疗新近发生的骨折,并预防再骨折。为促进骨质疏松性骨折的规范诊疗,优化骨质疏松性骨折二级预防策略,提高骨质疏松性骨折患者及风险人群的生存质量和健康水平,中国康复医学会骨质疏松预防与康复专业委员会牵头,通过改良Delphi法[4]制定了本共识。
共识制定小组首先在PubMed、Wiley Online Library、the Cochrane Library、Medline、Springer Link、Elsevier Science Direct、Ovid全文数据库、中国知网、维普网、万方数据库等中英文数据库中,以“osteoporotic fracture”“fragility fracture”“re-fracture”“prevention”“骨质疏松性骨折”“脆性骨折”“再骨折”“预防”等为检索词,检索发表于2022年6月之前的所有关于骨质疏松性骨折和再骨折预防的文献,筛选骨质疏松性骨折二级预防相关内容,在此基础上,制定共识Delphi研究草案,再邀请国内48位来自骨科、骨质疏松科、内分泌科、影像科及康复医学科等科室具有丰富骨质疏松防治经验的专家,共同参与了草案的修订。先后经过四轮会议讨论,最终将获得70%以上专家同意的内容纳入并撰写成本专家共识,同时形成12条推荐意见,供广大医务工作者参考。本专家共识所涉及的骨质疏松性骨折均指原发性骨质疏松所致的骨折。
全世界50岁以上人群中,有1/3~1/2的女性和1/5的男性将经历至少一次骨折[5-6]。2010年,全世界50岁以上人群中,约1.58亿人有骨质疏松性骨折高风险,预计至2040年,骨质疏松性骨折高风险人群将翻一番[7]。在我国,主要骨质疏松性骨折(髋部、椎体和腕部)2015年新增约269万例;预计2035年新增约483万例;2050年新增约599万例[8]。
骨质疏松性骨折后,可能导致患者丧失独立性、行走能力和从事日常活动的能力[9],还会影响其心理健康,降低总体生活质量,导致抑郁和孤立[10],甚至导致患者出现自杀倾向[11]。
骨折后,尤其是髋部和脊柱骨折后,由于疼痛、卧床、活动减少,使骨量进一步丢失,再骨折风险增加,形成恶性循环。部分患者甚至因心、肺等系统并发症而导致死亡[12-13]。高达17.1%~33.0%的患者在髋部骨折后的第1年内死亡[14-15]。骨质疏松性椎体压缩骨折(OVCF)保守治疗的4年死亡率也可高达49.4%[12]。
总之,骨质疏松性骨折严重危及健康老龄化,全社会均应重视老龄社会带来的挑战,重视骨质疏松性骨折的预防与控制,减少并发症、伤害和残疾。
推荐意见1:骨质疏松性骨折发病率逐年上升,危害大,社会、民众和医务人员均应高度重视。[推荐强度:推荐率100%(48/48),其中强烈推荐95.83%(46/48)、推荐4.17%(2/48)]
(一)风险因素
原发性骨质疏松所致的脆性骨折有众多风险因素:年龄>50岁人群中,年龄越大,罹患骨质疏松和发生骨质疏松性骨折的风险越高[16],即使具有相同的骨密度,老年人的骨折风险也要高于年轻人[17];女性较男性更容易发生骨质疏松和脆性骨折,在>50岁的人群中,女性骨折约为男性骨折的2倍[18];不同种族中,白种人和亚裔(黄种人)相对风险较黑色人种高[19];体质指数(BMI)与骨质疏松性骨折关系密切,但有性别差异,随着BMI增加,男性椎体骨折风险下降[20],但无论是BMI过高还是过低,都会增加绝经后女性脆性骨折风险[21];既往脆性骨折病史也是骨质疏松性骨折的风险因素,50~80岁的女性在发生了第一次脆性骨折后,在之后1年内发生骨折的风险是未发生过骨折女性的5倍[22];吸烟和酗酒均是骨质疏松性骨折的风险因素,戒烟和戒酒可降低其风险[23];骨密度低是骨折的高风险因素,骨密度改善越多,骨折风险降低越多[24];跌倒是导致老年人骨折的主要原因之一,导致跌倒的原因包括:平衡感下降,视力问题,肌少症,易导致跌倒的其他疾病,药物反应,环境风险等[25-26]。
(二)骨折风险评估工具
1. FRAX:registered:工具:该工具是通过研究欧洲、北美、亚洲和澳大利亚人群而开发的一种基于个体患者的骨折风险评估模型,由英国谢菲尔德大学于2008年首次发布[27]。该工具可在线使用,目前有77个国家或地区的86个版本。中国大陆人群可通过输入网址:https://www.sheffield.ac.uk/FRAX/tool.aspx?country=2而进行在线评估。
具有一个或多个骨质疏松性骨折临床危险因素,未发生骨折且骨量减少者(骨密度T值-1.0~-2.5 SD),可通过FRAX:registered:计算患者未来10年发生主要骨质疏松性骨折及髋部骨折的概率;临床上已诊断骨质疏松症(骨密度T值≤-2.5 SD)或已发生脆性骨折者,不必再用FRAX:registered: 评估骨折风险,应及时开始治疗[28]。
FRAX:registered:预测的髋部骨折概率≥3%或任何主要骨质疏松性骨折概率≥20%,为骨质疏松性骨折高危患者,建议给予治疗;任何主要骨质疏松性骨折概率为10%~20%时,为骨质疏松性骨折中风险;任何主要骨质疏松性骨折概率<10%时,为骨质疏松性骨折低风险[28-29]。
2. OSTA指数评估:该工具为亚洲人骨质疏松自我筛查工具,亦可用于脆性骨折的简易评估[30]。OSTA指数=[体重(kg)-年龄(岁)]×0.2[28]。OSTA指数>-1,为低风险;OSTA指数-1~-4,为中风险;OSTA指数<-4,为高风险[31]。低风险者一般不需要骨密度检测,除非伴有骨质疏松的其他风险因素;中风险者需行骨密度检测,如检测值较低则考虑药物治疗;高风险者需行骨密度检测,考虑药物治疗[30]。该工具较为简单,只涉及年龄和体重两个指标,特异度不高,需结合其他风险因素进行判断,且仅适用于绝经后妇女。
推荐意见2:由原发性骨质疏松导致的脆性骨折风险因素众多,如:年龄>50岁、女性、白种或黄种人、BMI过高或过低、既往脆性骨折病史、吸烟、酗酒、骨密度低、跌倒等。[推荐强度:推荐率100%(48/48),其中强烈推荐72.92%(35/48)、推荐27.08%(13/48)]
推荐意见3:可采用FRAX:registered:工具或OSTA指数对骨质疏松性骨折风险进行评估。如FRAX:registered:预测的髋部骨折概率≥3%或任何主要骨质疏松性骨折概率≥20%,或者OSTA指数<-4,建议予抗骨质疏松综合治疗。[推荐强度:推荐率89.58%(43/48),其中强烈推荐52.08%(25/48)、推荐37.50%(18/48),中立10.42%(5/48)]
(一)科普宣教
骨质疏松症和骨质疏松性骨折患者是否接受及什么时候接受骨质疏松的治疗是高度个体化的决定,甚至与医生设定的治疗阈值也不一致[32]。因此,对骨质疏松症和骨质疏松性骨折高风险人群或患者给予适当的科普宣教,对预防、治疗骨质疏松症,预防初次和二次骨折,提高患者的依从性都具有积极而重要的意义[32]。通过宣教,使高风险人群和患者[32-33]:(1)了解骨质疏松症和骨质疏松性骨折发生的原因、特点和相关并发症,骨折的治疗,抗骨质疏松治疗和定期随访的重要性,避免低能量损伤场景的措施等;(2)掌握自我管理和自我评估方法和正确的康复锻炼方法;(3)提高对骨质疏松防治知识和技能的掌握,促进其主动参与骨质疏松的控制。
(二)健康规划
做好老年人健康规划,有益于持续发展和维护老年人健康生活所需的内在能力,有利于提高老年人生活质量,并有助于实现健康老龄化,具体措施包括[34-35]:培养积极的生活方式,生活起居规律,保持一定的户外活动和日照;维持合适的体重;戒烟;避免过度饮酒;适当培养兴趣爱好;端正心态,对生活抱积极态度;定期健康体检。
(三)均衡饮食
人体所需的大多数营养均通过食物摄入。食物中缺乏营养会导致生长发育障碍、骨骼脆弱和其他疾病。考虑到我国人群的膳食结构,骨质疏松症和骨质疏松性骨折患者及高风险人群膳食原则应膳食多样化,保证谷薯类摄入,保证蛋白质摄入,足量饮水,清淡饮食,控制添加糖的摄入量,具体可参照《原发性骨质疏松症患者的营养和运动管理专家共识》[36]。
(四)适当运动
适当运动可以改善身体机能、骨量、肌肉力量和平衡,还可以降低跌倒的风险。每周应进行3~4次至少30 min的适当负重和肌肉锻炼;对于高龄老年人,建议低强度日常活动及体育运动;全身振动训练可作为改善骨质疏松症患者骨密度、运动能力和相关功能参数的治疗手段;进行平衡训练可改善平衡能力,预防跌倒和骨折[37-38]。
(五)补充营养素
与骨骼关系最密切的营养素包括钙、维生素D和蛋白质,合理摄入这些营养素有助于骨骼健康,并可降低骨质疏松和脆性骨折的风险[39]。
表1为中国居民膳食营养素参考摄入量中对老年人的钙、维生素D和蛋白质膳食参考摄入量建议[40]。
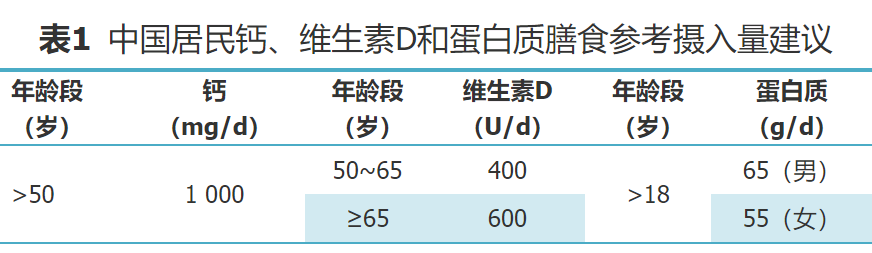
50岁及以上人群每天应摄入1 000 mg钙,除了每日从膳食摄入钙(约400 mg)以外,还需要补充元素钙约600 mg/d[40]。
维生素D 用于骨质疏松症防治时的剂量可为800~1 200 U/d[28];老年人由于肝肾功能不足,无法对维生素D进行充分羟化,故可适当补充活性维生素D[41]。
对于骨质疏松症患者,一般建议每天至少摄入1 g/kg体重的蛋白质,老年人甚至建议摄入1.2 g/kg体重的蛋白质[41]。如果钙摄入量充足,骨质疏松症患者的饮食中摄入更多蛋白质,可能有助于减少骨质流失和骨折风险[41]。
(六)避免低能量损伤场景
虽然很多骨质疏松性骨折由跌倒导致,但任何低能量损伤场景,包括但不限于跌倒、取重物、弯腰、高举后仰躯体、迅速转身等都可能导致骨质疏松性骨折,因此,应尽量避免低能量损伤场景。具体指导意见如下[25,42-43]:骨质疏松性骨折高风险人群应评估独立活动时的肌力和平衡能力,如肌力和平衡力较差时,应采取防跌倒措施:建议穿防滑鞋以获得更好的抓地力;尽量避免行走在湿滑地面;外出时尽量利用扶手,必要时使用手杖或助行器等辅助行走工具;检查家中是否存在易致跌倒的因素,如楼梯、地毯、电线、网线、数据线、踏脚凳及潮湿的地面等;使用合适的坐具;在浴室安装扶手和可折叠的淋浴椅等。
尽量避免拿取重物,且拿取物品时动作尽量舒缓,适当使用辅助工具,如用拾物器、鞋拔子、长臂吸尘器等帮助完成日常动作或劳动。规划物品放置,常用的物品应放在容易够到的地方,尽量避免较大幅度弯腰或高举后仰躯体拿取。尽量避免迅速转身等动作。
推荐意见4:建议对骨质疏松性骨折高风险人群给予适当的科普宣教,指导其健康规划、均衡饮食、适当运动等,有助于提高其对骨质疏松和脆性骨折的认识、预防初次和二次骨折。[推荐强度:推荐率100%(48/48),其中强烈推荐81.25%(39/48)、推荐18.75%(9/48)]
推荐意见5:骨质疏松性骨折高风险人群在日常合理摄入钙、维生素D和蛋白质等营养素,有助于降低脆性骨折风险。[推荐强度:推荐率100%(48/48),其中强烈推荐64.58%(31/48)、推荐35.42%(17/48)]
推荐意见6:骨质疏松性骨折高风险人群应尽量避免低能量损伤场景,包括但不限于:跌倒、取重物、较大幅度弯腰、高举后仰躯体、迅速转身等。[推荐强度:推荐率95.83%(46/48),其中强烈推荐62.50%(30/48)、推荐33.33%(16/48),中立4.17%(2/48)]
(一)骨质疏松性骨折的早期识别
由于大部分骨质疏松性脊柱骨折均由跌倒以下的轻微外力导致,故对于老年人,应注意无明显外伤史出现的腰背痛,还应注意身高变化,如身高每年降低超过2 cm,则考虑有骨质疏松性脊柱骨折,可适当予影像学检查(X线平片、CT、MRI),以提高胸腰椎骨折的诊断率。此外,只要符合脆性骨折特点,又排除了继发性骨质疏松和骨肿瘤等,均可诊断为骨质疏松性骨折,而无需等待骨密度检查结果再做出诊断。同时应尽早开始抗骨质疏松治疗[43],在治疗时也要充分考虑到骨质疏松性骨折的特点[1]。
(二)骨质疏松性骨折的诊断
1. 临床表现:四肢骨质疏松性骨折除了骨折的一般表现,如疼痛、肿胀、功能障碍,以及骨折特有表现,如畸形、异常活动、骨擦音(感)等,最重要的是由低能量非暴力损伤所导致。但大多数骨质疏松性脊柱骨折患者无明显外伤或仅有轻度外伤(如扭伤、颠簸、平地滑倒等),甚至咳嗽、喷嚏、弯腰等日常动作即可引起骨折,亦可无特异性症状、体征[44]。
2.影像学检查:X线:对于四肢骨折和部分脊柱骨折,X线检查可明确骨折的部位、类型、移位方向和程度,对骨折的诊断、鉴别诊断、分型及治疗决策有重要价值。椎体压缩骨折时,有楔形变或“双凹征”改变,部分可表现为椎体内“裂隙征”或假关节形成[45]。可采用Genant半定量评估法通过胸腰椎侧位X线片对椎体骨折程度进行分型[46]。除了骨折,X线平片还可表现为骨小梁稀少,骨密度降低,但这些影像表现受主观因素影响大,且对早期骨量丢失不敏感。
CT:可用于判断骨折的严重程度和粉碎情况,关节面是否完整,椎体压缩程度,椎体周壁是否完整,椎体后缘是否有骨块突入椎管,以及椎管受侵害的程度[1,44]。
MRI:MRI检查较为敏感,可以发现X线或CT显示不清的隐匿性骨折和软骨及软组织损伤,尤其有助于判断椎体压缩骨折为新鲜还是陈旧骨折,明确疼痛责任椎[1,44],通常在MRI上显示椎体水肿,在T1加权像(T1WI)表现为低信号,T2加权像(T2WI)为低信号或混杂信号,脂肪抑制序列显示高信号[47]。
ECT:骨折时ECT检查可显示放射性核素浓聚,当患者不能进行MRI检查时可作为一种替代方法,也有助于排除骨骼系统有无病灶[44]。
3.骨密度检查:对于已经发生脆性骨折的患者,骨密度作为诊断依据并非必需,但骨密度检查对于骨质疏松本身和再骨折风险评估有较大价值,因此,建议条件允许情况下对骨质疏松性骨折患者和骨折高风险者定期行骨密度检查。目前临床常用的骨密度检查方法是双能X线吸收检测法(DXA)和定量CT(QCT),常规CT可作为补充。
(1)DXA:参照WHO推荐的诊断标准,DXA测定T值≥-1.0 SD属正常;-2.5 SD<T值<-1.0 SD为骨量低下或骨量减少;T值≤-2.5 SD为骨质疏松症。骨密度降低程度符合骨质疏松症诊断标准,同时伴有一处或多处脆性骨折为严重骨质疏松症[1,29]。不同人种数据库计算所得T值有所差异,可能会影响骨质疏松症的诊断和检出率,建议使用DXA应遵循我国骨质疏松症诊疗指南采用中国人数据库计算T值[48]。临床上DXA常用的测量部位是腰椎椎体及髋部,感兴趣区(ROI)包括L1~4、股骨颈和全髋部。但DXA测量的面积骨密度受体重、脊柱侧凸、骨质增生、椎体骨折和血管钙化等因素影响,可能会降低骨密度检查的准确性[49]。
(2)QCT:一般取2个腰椎松质骨骨密度平均值(常用L1和L2),采用腰椎QCT骨密度绝对值进行诊断,骨密度绝对值>120 mg/cm3为骨密度正常,骨密度绝对值于80~120 mg/cm3范围内为低骨量,骨密度绝对值<80 mg/cm3为骨质疏松[50]。QCT更适于体重过低、严重肥胖、脊柱侧凸或脊柱退变等患者[50]。QCT单独使用的辐射剂量高于DXA,故在临床使用中,QCT应尽量与临床CT扫描同步进行,推荐使用低剂量技术[50-51]。
(3)常规CT:除了各类脊柱CT扫描,胸腹部CT扫描也可能覆盖胸腰椎椎体,通过在CT图像中测量椎体松质骨CT值,有助于识别骨质疏松患者[52]。目前,椎体松质骨CT值诊断骨质疏松症的标准尚不统一,且不同厂家CT机测得的椎体松质骨CT值可能存在差异,但因可利用现有的CT扫描数据,故可作为脊柱尤其腰椎退行性疾病患者诊断骨质疏松症的补充方法。
4.实验室检查:实验室检查有助于明确原发性骨质疏松症的诊断,对于排除转移性骨肿瘤、胸腰椎结核、多发性骨髓瘤、骨软化症和甲状旁腺功能亢进等内分泌疾病、类风湿性关节炎等免疫性疾病,以及长期服用糖皮质激素或其他影响骨代谢药物等亦有价值。
实验室检查包括一般项目如血常规,尿常规,肝、肾功能,血钙、血磷和碱性磷酸酶水平,25羟维生素D(25OHD)和甲状旁腺素(PTH)水平,以及骨转换生化标志物,推荐检测血清1型原胶原N-端前肽(P1NP)和1型胶原C-末端肽交联(CTX),分别为反映骨形成和骨吸收敏感性较高的标志物[53]。
上述一般生化检查项目和骨转换生化标志物,有助于代谢性骨病的诊断和鉴别诊断、疾病管理、骨转换率判断、骨折风险预测、骨质疏松治疗方案选择和抗骨质疏松药物疗效监测等[53]。
5.诊断与鉴别诊断:骨质疏松性骨折的诊断应结合患者的年龄、性别、绝经史、低能量损伤史、既往脆性骨折史、临床表现及影像学和骨密度检查结果、血生化指标、骨转换生化标志物等进行综合分析,作出诊断。骨质疏松性骨折诊断流程如图1所示。注意需与转移性骨肿瘤、胸腰椎结核、多发性骨髓瘤、骨软化症和甲状旁腺功能亢进等内分泌疾病、类风湿性关节炎等免疫性疾病,以及各种先天或获得性骨代谢异常疾病相鉴别[1,53]。
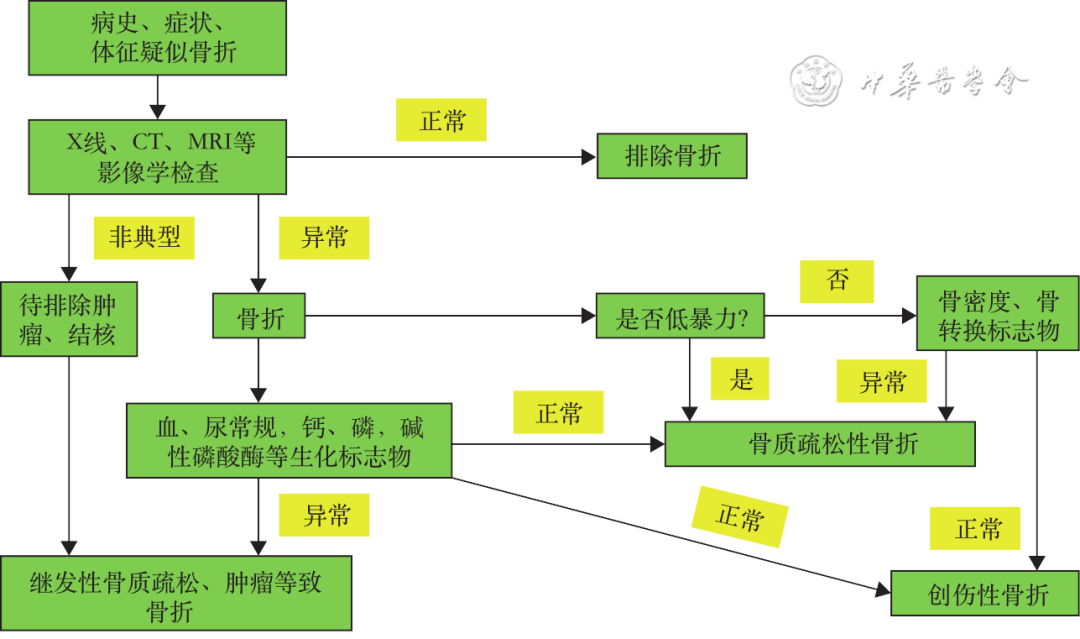
图1 骨质疏松性骨折诊断流程图
推荐意见7:骨密度检查对于骨质疏松性骨折的诊断并非必需,但其对于骨质疏松本身和再骨折风险评估有较大价值,故建议条件允许情况下对骨质疏松性骨折患者和骨折高风险者定期行骨密度检查。[推荐强度:推荐率97.92%(47/48),其中强烈推荐66.67%(32/48)、推荐31.25%(15/48),中立2.08%(1/48)]
推荐意见8:骨质疏松性骨折的诊断应结合多因素综合分析,如患者年龄、性别、绝经史、低能量损伤史、既往脆性骨折史、临床表现及影像学和骨密度检查结果、血生化指标、骨转换生化标志物等。[推荐强度:推荐率95.83%(46/48),其中强烈推荐60.42%(29/48)、推荐35.42%(17/48),中立4.16%(2/48)]
(一)治疗原则和流程
骨质疏松性骨折治疗的基本原则是复位、固定、功能锻炼和抗骨质疏松治疗[1],但具体应根据不同年龄、不同部位、不同骨折类型做出相应处理。还需要对患者进行全程管理,预防再骨折。骨质疏松性骨折治疗流程如图2所示。
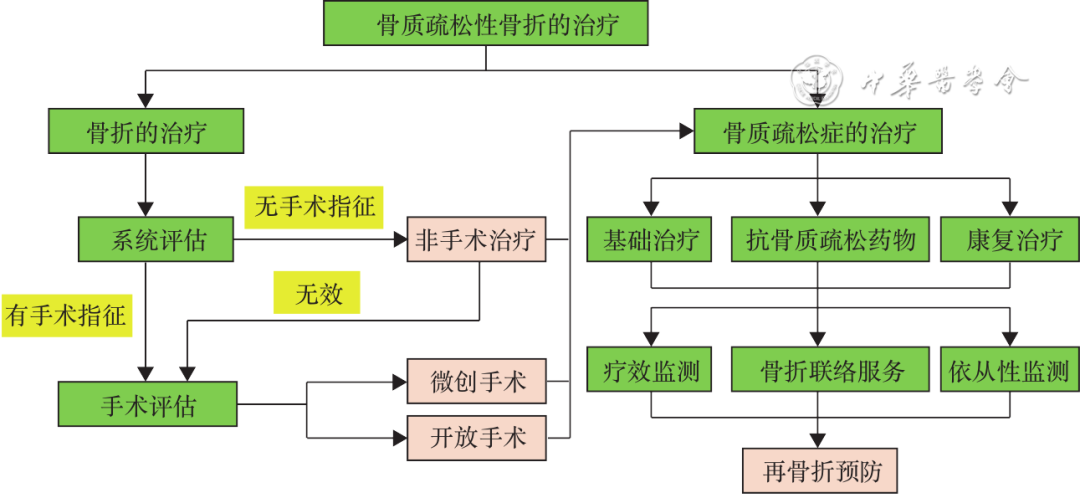
图2 骨质疏松性骨折治疗流程图
(二)基础治疗
骨质疏松性骨折的诊断一旦成立,在骨折治疗评估的同时,甚至在之前,即可开始基础治疗,即补充钙和维生素D。对于骨质疏松性骨折患者,应适当增加钙的摄入,建议每天至少摄入1 000 mg钙[40,54]。首选通过膳食补充钙,且建议以少量多次的方式摄入。如使用钙补充剂,应在进餐时服用,以提高耐受性和增加钙吸收;最高钙摄入量应<2 000 mg/d,高钙血症及高尿钙症患者应避免使用钙剂,以避免增加肾结石和心血管疾病风险[54]。
维生素D用于骨质疏松症防治时剂量可为800~1200 U/d,老年患者或有肾脏疾病的患者可适当选用活性维生素D[41,54],也可酌情检测血清25OHD水平,定期监测血清钙及24 h尿钙浓度,以指导维生素D的补充[54]。
(三)抗骨质疏松药物治疗
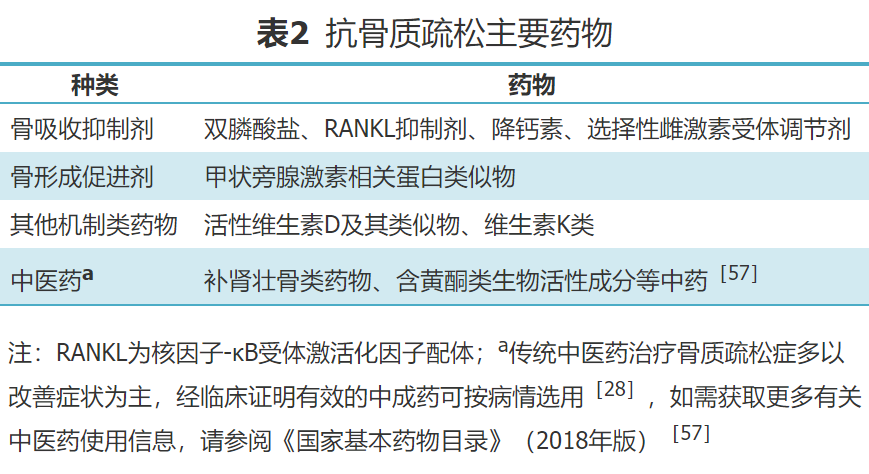
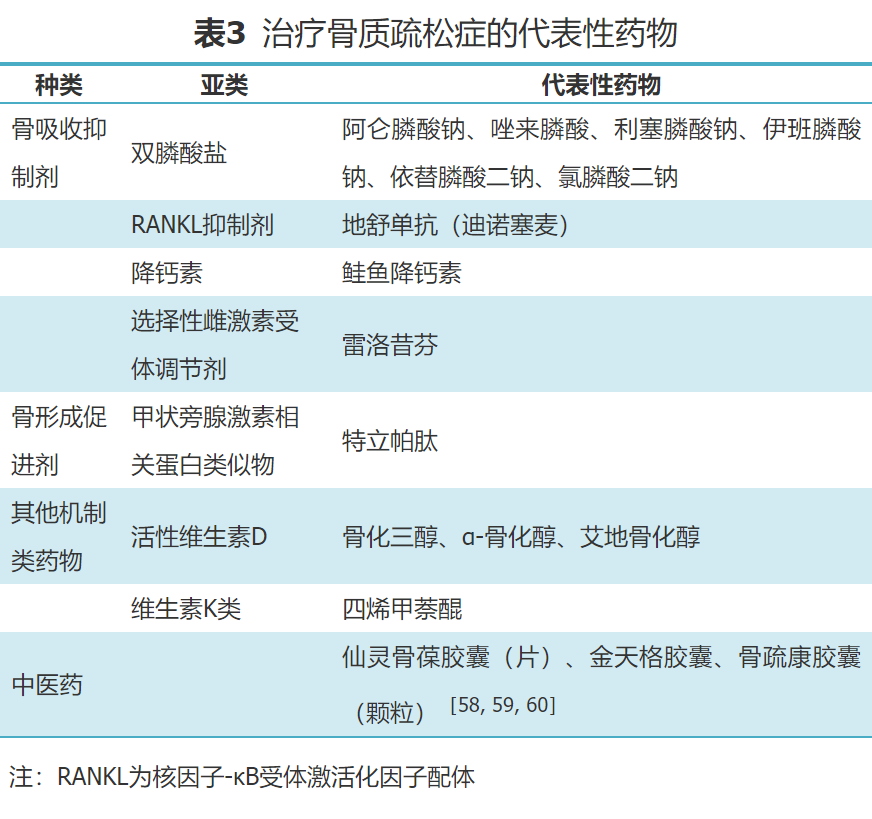
对于已发生脆性骨折的患者,无论其骨密度检查是否异常,都应进行抗骨质疏松药物治疗,以增加骨密度,改善骨质量,降低再骨折发生的风险。抗骨质疏松药物按作用机制可分为骨吸收抑制剂、骨形成促进剂、其他机制类药物及中医药[1,44,54](表2),用于治疗骨质疏松症的代表性药物见表3。美国内分泌医师协会(AACE)和美国内分泌协会(ACE)2020版《绝经后骨质疏松症诊疗临床实践指南》[55]将新近发生骨折(过去12个月内)、抗骨质疏松治疗期间发生骨折、多处骨折、药物(如长期使用糖皮质激素)致骨骼损伤而导致的骨折、极低的骨密度(T值<-3.0 SD)、跌倒风险高或有过伤害性跌倒史、FRAX:registered:或其他骨折风险评估工具评估结果为骨折概率极高(10年主要骨质疏松部位骨折概率>30%或髋部骨折概率>4.5%)的骨质疏松患者定义为骨折极高风险患者;将诊断为骨质疏松症但不具有上述骨折极高风险的患者定义为骨折高风险患者。对于骨折极高风险患者,推荐选择阿巴洛肽(国内未上市)、地舒单抗、romosozumab(国内未上市)、特立帕肽、唑来膦酸等注射剂型药物作为初始治疗方案;对于骨折高风险患者,推荐阿仑膦酸、地舒单抗、利塞膦酸、唑来膦酸作为初始治疗药物[55]。鲑鱼降钙素可阻止急性骨丢失,缓解骨质疏松及其骨折后的骨痛,建议在骨质疏松的制动患者中使用[56],必要时可采用间歇性重复给药[28]。
抗骨质疏松药物使用时长:双膦酸盐治疗可持续5~7年,评估风险和收益后决定后续治疗方案,后续的治疗方案包括:维持治疗、更换药物以及药物假期[54]。非双膦酸盐骨吸收抑制剂不建议进入药物假期。地舒单抗持续使用10年,骨密度仍维持增长,且安全性良好[61],如果停用,应立刻使用其他骨吸收抑制剂[55]。甲状旁腺激素相关蛋白类似物的治疗时间不应超过24个月[62]。药物假期中,钙剂和维生素D仍应按需要量维持使用。
联合和序贯用药:钙剂和维生素D作为骨基本补充剂,可以与骨吸收抑制剂或骨形成促进剂联合使用。一般情况下,不建议同时应用相同作用机制的药物来增强抗骨质疏松治疗的效果。骨形成促进剂和骨吸收抑制剂联合使用没有明显的协同作用,患者获益有限[63]。骨形成促进剂治疗结束后,推荐序贯使用骨吸收抑制剂,以维持骨形成促进剂取得的疗效[55]。
(四)骨折的专科治疗
针对脊柱骨折、髋部骨折、桡骨远端骨折、肱骨近端骨折等四种最常见的骨质疏松性骨折的专科治疗,应根据骨折部位,骨折类型,患者年龄、症状体征和全身情况等综合考虑,采用保守治疗、微创椎体强化、闭合复位内固定、切开复位内固定或人工关节置换术等治疗[44,64-69]。手术治疗者可行围手术期加速康复外科(ERAS)管理。
(五)骨质疏松性骨折的康复治疗
骨质疏松性骨折的康复治疗的近期目标是缓解疼痛,增强肌力与耐力,改善平衡功能,提高关节活动度,预防跌倒,提高日常生活活动能力。远期目标是降低骨折风险,提高参与能力,提高骨密度或延缓骨密度下降,改善患者生活质量[69]。主要包括运动疗法、物理因子治疗、作业疗法及康复工程等[28,37-38,67]。
推荐意见9:骨质疏松性骨折的药物治疗建议补充骨代谢所必需的原料,如维生素D和钙等,根据实际情况选择合适的抗骨质疏松药物,例如:骨吸收抑制剂、骨形成促进剂、其他机制类药物、中医药等。[推荐强度:推荐率97.92%(47/48),其中强烈推荐72.92%(35/48)、推荐25.00%(12/48),中立2.08%(1/48)]
推荐意见10:骨质疏松性骨折的专科治疗,应根据骨折部位,骨折类型,患者年龄、症状体征和全身情况等综合考虑,采用相应治疗,例如:保守治疗、微创椎体强化、闭合复位内固定、切开复位内固定或人工关节置换术等;同时,建议予积极、规范、综合的康复治疗。[推荐强度:推荐率95.83%(46/48),其中强烈推荐75.00%(36/48)、推荐20.83%(10/48),中立4.17%(2/48)]
骨质疏松性骨折后再骨折的预防除了对骨折和骨质疏松症的正规治疗,还需要对骨折患者进行全程随访监测和健康指导。
(一)疗效监测
骨质疏松性骨折治疗后,应定期随访,监测疗效,及时了解并处理不良反应、骨折愈合情况、钙和维生素D的摄入是否充足、临床症状改善情况、再骨折预防实施情况、新出现的可能改变治疗预期效果的共患病等;还应定期检测骨密度(1年1次)或每3~6个月复查骨转换标志物[28,53];同时,每年应进行精确的身高测量及脊柱影像学检查,当患者身高缩短2 cm以上,或脊椎影像学检查出现异常,应明确是否有新的骨折发生[1,44]。抗骨质疏松治疗的疗效监测,在药物首次治疗或改变治疗后开始。
(二)依从性监测
骨质疏松性骨折治疗后,应全程监测患者依从性,包括用药依从性、健康指导依从性和随访依从性[68]。有效的医患沟通;密切监测,及早发现存在的问题,使患者树立有效治疗可降低骨折风险的信念;及时告知患者骨转换生化标志物和骨密度结果,并解释其与骨折风险下降相关,鼓励患者坚持治疗;使患者认识到不接受治疗的风险远高于药物不良反应带来的风险;定期就近随访;应用简便的治疗方案等,均有助于增强患者对治疗的依从性[28,68-69]。
(三)骨折联络服务(FLS)
2012年,国际骨质疏松基金会(IOF)发起主题为“攻克骨折”(Capture the Fracture:registered:)的全球计划,以促进骨折后护理(PFC)协调计划的实施,主要为FLS,以预防继发性骨折[70]。目前,IOF已经在50个国家建立688个FLS项目。
FLS项目的实施可以有效提高脆性骨折患者骨质疏松症的诊断率、抗骨质疏松药物的使用率和依从性,减少医疗花费,降低再骨折率和死亡率[71]。而持续的公众健康教育,医疗资源投入与合理的人员分配,强化跨学科合作,提供便捷有效的治疗与随访等也有助于进一步提高FLS项目的效果[72]。
推荐意见11:建议对骨质疏松性骨折患者进行全程管理,每年精确测量身高,条件允许情况下应在治疗后每1年检测1次骨密度,或每3~6个月复查骨转换标志物。[推荐强度:推荐率93.75%(45/48),其中强烈推荐54.17%(26/48)、推荐39.58%(19/48),中立6.25%(3/48)]
推荐意见12:建议有条件的医疗机构适时开展FLS。[推荐强度:推荐率89.58%(43/48),其中强烈推荐37.50%(18/48)、推荐52.08%(25/48),中立10.42%(5/48)]
骨质疏松性骨折严重威胁老年人群健康,但目前的诊疗现状仍有待改善。应增强社会、民众和医务人员对其的重视程度,早期发现、早期诊断、早期治疗,规范骨折和骨质疏松症的治疗,对骨折患者进行全程管理,降低再骨折发生率,改善其生活质量,减轻家庭、社会负担,促进实现健康老龄化。
综上,本共识仅为阶段性学术指导意见,并无任何强制力,亦不作为法律依据,且随着医学的发展和循证医学证据的增加,本共识的部分内容也需要不断完善和更改。在具体的临床诊疗过程中,应根据实际情况而采用对应措施,做到个性化诊疗,以造福广大患者。
本共识制订专家委员会名单
牵头专家:杨惠林(苏州大学附属第一医院骨科);章振林(上海交通大学医学院附属第六人民医院骨质疏松和骨病专科);李建军(中国康复研究中心脊柱脊髓神经功能重建科)
执笔专家:周军(苏州大学附属第一医院骨科);孟斌(苏州大学附属第一医院骨科);毛海青(苏州大学附属第一医院骨科)
参与讨论专家(按姓氏汉语拼音排序):昌耘冰(广东省人民医院脊柱外科);陈博来(广东省中医院骨伤专科);陈亮(苏州大学附属第一医院骨科);陈廖斌(武汉大学中南医院骨科);陈允震(山东大学齐鲁医院骨科);程黎明(上海市同济医院骨科);程晓光(北京积水潭医院放射科);方向前(浙江大学医学院附属邵逸夫医院骨科);海涌(首都医科大学附属北京朝阳医院骨科);侯志勇(河北医科大学第三医院骨科创伤急救中心);胡侦明(重庆医科大学附属第一医院骨科);黄伟(重庆医科大学附属第一医院骨科);李春海(中山大学孙逸仙纪念医院骨外科);李淳德(北京大学第一医院骨科);李锋(华中科技大学同济医学院附属同济医院骨科);李浩鹏(西安交通大学第二附属医院骨科);李建军(中国康复研究中心脊柱脊髓神经功能重建科);李危石(北京大学第三医院骨科);梁裕(上海交通大学医学院附属瑞金医院骨科);林海滨(莆田学院附属医院骨科);林华(南京鼓楼医院骨科);刘宏建(郑州大学第一附属医院骨科);刘军(中南大学湘雅二医院医学影像科);陆声(云南省第一人民医院骨科);罗湘杭(中南大学湘雅医院内分泌科);马昕(复旦大学附属华山医院骨科);毛海青(苏州大学附属第一医院骨科);孟斌(苏州大学附属第一医院骨科);全仁夫(浙江中医药大学附属江南医院骨伤科);申才良(安徽医科大学第一附属医院骨科);沈彬(四川大学华西医院骨科);沈慧勇(中山大学附属第八医院骨科);唐海(首都医科大学附属北京友谊医院骨科);吴斗(山西白求恩医院骨科);吴新宝(北京积水潭医院创伤骨科);熊小明(成都体育学院附属体育医院脊柱病科);徐又佳(苏州大学附属第二医院骨质疏松症临床中心);薛庆云(北京医院骨科);闫景龙(哈尔滨医科大学附属第二医院骨科);杨惠林(苏州大学附属第一医院骨科);银和平(内蒙古医科大学第二附属医院脊柱外科中心);张斌(南昌大学第一附属医院骨科);章振林(上海交通大学医学院附属第六人民医院骨质疏松和骨病专科);仉建国(中国医学科学院北京协和医院骨科);郑召民(中山大学附属第一医院脊柱外科);周军(苏州大学附属第一医院骨科);周宗科(四川大学华西医院骨科);朱悦(中国医科大学附属第一医院骨科)
本文转载于<中华医学杂志>,版权归中华医学会所有,如有侵权请联系我们删除。