
高血压与高胆固醇血症既有独立的致病机制,又存在一定的相互作用,共同促进动脉粥样硬化(AS)的发生与发展。基于我国高血压与血脂异常(以高胆固醇血脂为主)的高伴发率,以及高血压、血脂异常的低治疗率、低控制率,针对高血压和高胆固醇血症在动脉粥样硬化性心血管病(ASCVD)发生与发展中的机制和相互作用,联合干预对延缓疾病进展、降低心血管相关事件发生风险具有积极意义。
病理生理
1. 高血压导致动脉硬化的病理生理特点
高血压导致动脉硬化除了压力负荷外,还可启动炎症反应;其中合并多重危险因素患者最突出的特点是肾素血管紧张素醛固酮系统(renin-angiotensin-aldosteronesystem, RAAS)高度激活,主要表现为血管紧张素Ⅱ(angiotensinⅡ, AngⅡ)显著升高、缓激肽活性和Ang1-7活性降低。这种内在机制的变化对心血管系统的结构与功能产生诸多不良影响,如引起血管收缩、组织炎症反应、氧化应激、组织凋亡等,导致血压进一步升高。
2. 高血压与高血脂症在AS发病中的作用
AS是高血压患者发生心脑血管病及事件的病理基础,而AS与血管内皮损伤、动脉硬化、炎症、脂质沉积等多种病理生理机制有关。高血压与高胆固醇血症既有独立的致病机制,又存在一定的相互作用,共同促进AS的发生与发展。持续性高血压可导致血流紊乱,剪切力增加,导致内皮功能异常与氧化应激加剧,造成内皮损伤与炎症反应。沉积在内皮下的LDL-C可被氧化为氧化型低密度脂蛋白(oxidationlowlipoprotein, ox-LDL-C),被巨噬细胞吞噬,后者成为泡沫细胞,进一步介导内皮炎症反应与氧化应激。此外,高血压尚可导致内皮损伤与动脉硬化,使内皮对LDL-C穿透与再摄取能力增强。
多重危险因素高血压的管理
1. 血压管理目标
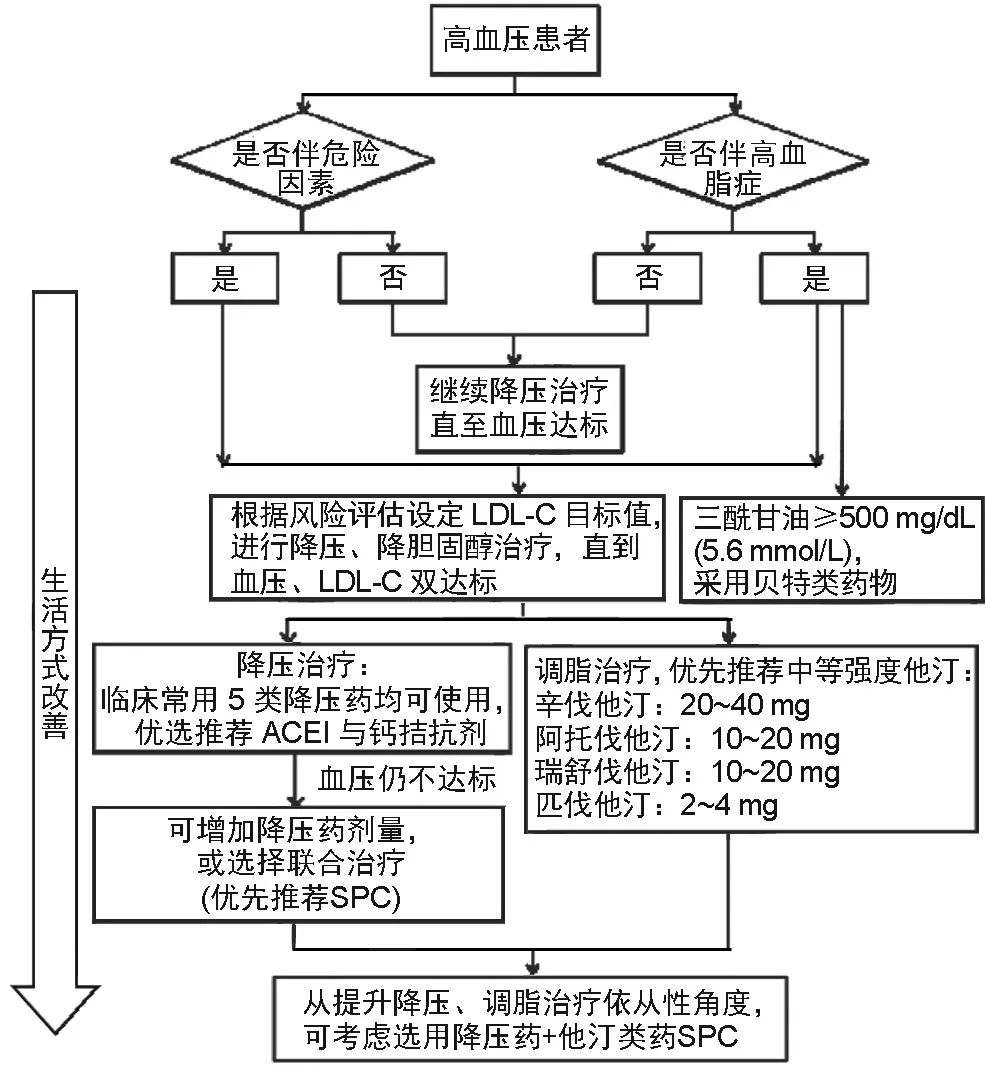
高血压治疗的根本目标是降低发生心脑肾及血管并发症和死亡的总危险。应根据高血压患者的总体风险水平决定给予降压和调脂的双达标策略,同时干预可纠正的危险因素、靶器官损害和并存的临床疾病,降低总体心血管事件和全因死亡风险。
一般高血压患者血压应降至<140/90mmHg;能耐受者和部分高危及以上的患者血压可进一步降至<130/80mmHg,对于合并危险因素的高血压患者,结合患者的危险分层情况,在可以耐受的情况下,应尽量将血压控制在<130/80mmHg。
2. 高血压患者降胆固醇管理
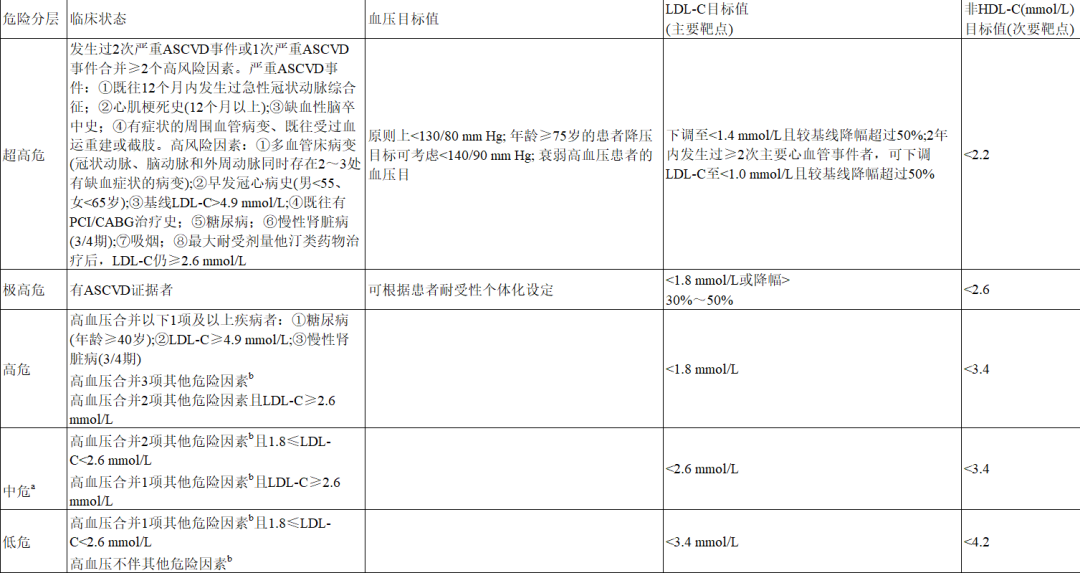
基于《中国成人血脂异常防治指南(2016版)》和《中国高血压防治指南(2018年修订版)》的危险因素分层标准:ASCVD患者均为极高危患者(二级预防)。对非ASCVD患者(一级预防)须基于LDL-C水平、有无高血压,以及其他危险因素(包括吸烟、低HDL-C及男性年龄≥45岁或女性年龄≥55岁)进行10年ASCVD风险评估。
①ASCVD一级预防人群:识别、明确需要降胆固醇治疗的高血压患者,尽早启动他汀类药治疗,在血压达标的基础上实现LDL-C达标,尽可能降低ASCVD发病风险。
②ASCVD二级预防人群:所有ASCVD患者须在降压达标的基础上,通过积极的他汀或他汀+非他汀类药物治疗将LDL-C降低至<1.8mmol/L,延缓ASCVD疾病进展,以降低死亡风险,延长患者生存期并提高生活质量。
根据ASCVD危险分层评估,《中国成人血脂异常防治指南(2016年版)》建议:LDL-C为首要治疗靶标。他汀类药为降脂治疗的基石和首选药物。
对ASCVD危险分层评估为中危及以上的高血压患者,均应立即启动降脂药物治疗。对于极高危患者,在血压达标基础之上,通过药物干预将LDL-C降至<1.8mmol/L;对从未使用过降脂药物的患者,若其LDL-C已低于目标水平,则亦须使用起始剂量的他汀类药治疗,使LDL-C降低幅度>30%。
生活方式改善
1. 限盐和合理膳食限制氯化钠摄入量<6g/d;控制胆固醇摄入量,建议摄入量<300mg/d;推荐食用全谷物、豆类和新鲜蔬菜水果等食品,限制摄入高热量食品(如动物脂肪、甜食、含糖饮料等)。
2. 戒烟所有患者应严格戒烟并避免接触二手烟。
3. 减重控制体质量正常(体质量指数<24kg/m2)、腹围正常(男性<90cm、女性<85cm)。
4. 增加身体活动推荐患者进行中等强度的身体活动(如步行、慢跑、骑自行车、游泳等),4~7d/周,累计30~60min/d。
5. 不饮或限制饮酒建议高血压合并高血脂症患者不饮酒。如饮酒,酒精摄入量应限制在<25(男性)、<15g/d(女性),或白酒、葡萄酒、啤酒摄入量分别<50、100、300mL/d。
6. 减轻精神压力,保持心理平衡。
药物选择
1. 降压治疗药物
基于高血压合并高血脂及多重危险因素患者发生动脉硬化和AS的风险较高,并存在较高的RAAS的激活,此类患者优先推荐钙拮抗剂和RASI,尤其是长效制剂。
在多种钙拮抗剂中苯磺酸氨氯地平有35~52h的半衰期及较多的降压和抗动脉硬化的循证医学证据,因此是临床优先推荐的一种钙拮抗剂。在RASI中的ACEI、血管紧张素受体拮抗剂(angiotensinreceptorblocker,ARB)类药物虽有多种,培哚普利血浆半衰期>30h,在与4种RASI比较中其降低24h和夜间血压方面优于其他RASI。
部分利尿剂与β受体阻滞剂可影响脂代谢,不同程度地造成血脂水平的改变。因此,对于高血压合并高胆固醇血症的患者,宜小剂量用药。
2. 调脂治疗药物
包括他汀类药(辛伐他汀、阿托伐他汀、瑞舒伐他汀及匹伐他汀等)、血脂康、胆固醇吸收抑制剂(如依折麦布)、以及同时具有降压和降胆固醇作用的复方制剂。
在药物选择中应注意以下几个方面的问题:
①对初诊高胆固醇血症(LDL-C大于前述各危险分层的目标值)的患者,推荐起始采用中等强度的他汀类药治疗,治疗后4~6周复查血脂谱。LDL-C达标后,继续他汀类药的长期治疗。如单用他汀类药未能使LDL-C达标,应联用胆固醇吸收抑制剂以获得更显著的降胆固醇疗效。
②对他汀类药治疗后LDL-C达标、而非HDL-C(非HDL-C=总胆固醇-HDL-C)未达标的患者,首先推荐生活方式改善(低脂膳食、戒酒、避免摄入过量碳水化合物、增加活动、降低体质量),糖尿病患者应积极控制血糖,必要时可考虑联用贝特类药物。在老年、肝肾功能不全患者,应避免大剂量他汀类药与贝特类药的联合。
③具有降压和降胆固醇作用的复方制剂(如阿托伐他汀10mg或20mg+氨氯地平)适用于大多数高血压伴高胆固醇血症患者的降脂治疗,并可以使大多数患者LDL-C达标。复方制剂有助于减少给药数量,提高长期治疗的依从性。给药后根据患者情况,必要时联合其他降压或调脂药物以获得血压、血脂双重达标。
④初始给药后4~6周应复查血脂谱、肝功能和肌酸激酶。肝酶超过正常上限3倍或肌酸激酶超过正常上限5倍应暂停降脂药物;治疗后出现肌肉症状(肌无力、肌痛)者也需暂时停药。待生化指标恢复正常、肌肉症状消失后,可酌情尝试低剂量他汀类药或血脂康联合依折麦布,或单用依折麦布治疗,仍不能耐受或无效的极高危ASCVD患者应考虑采用前蛋白转化酶枯草溶菌素9(pro-proteinconvertasesubtilisin/kexin9,PCSK9)抑制剂治疗。
3. 相互不良作用
①钙拮抗剂与他汀类药:高脂溶性他汀类药如辛伐他汀、洛伐他汀在体内主要依赖细胞色素P450酶中的CYP3A4代谢,氨氯地平能够抑制CYP3A4而减慢这两种他汀类药的代谢,导致它们的血药浓度升高,增加了肌病的发生风险。因此,氨氯地平与辛伐他汀、洛伐他汀合用时两药的剂量均应≤20mg/d。硝苯地平控释片、非洛地平缓释片对CYP3A4的抑制作用相对弱,与他汀类药的药物相互作用不明显。目前氨氯地平(5mg)与阿托伐他汀(10~20mg)组成的SPC相对安全。
②RASI与他汀类药:临床常用的ACEI尚无与其他药物在代谢方面发生具有重要临床意义相互作用的报道。替米沙坦、缬沙坦、奥美沙坦酯不经细胞色素P450酶代谢。厄贝沙坦主要由细胞色素酶P4502C9氧化。上述ARB与他汀类药合用不影响相互的药代动力学。
小结
1. 一旦确诊为高血压,在早期就需进行全面的ASCVD危险筛查并进行评估,明确降压和降脂目标值;
2. 无论是否用药,均建议在日常生活中改掉不良的生活习惯,重视生活方式的干预,倡导形成个体化的治疗方案;
3. 立即启动降压联合降LDL-C的药物治疗是所有ASCVD风险中危以上高血压人群最重要的治疗措施;
4. 年龄<55岁的ASCVD风险中危高血压患者,需对余生心血管病风险进行评估,风险等级为高危或LDL-C≥2.6 mmol/L者,可考虑采用药物降LDL-C,前提是在此之前已经开始了生活方式的改变。
声明:本文为原创内容,作者陶宇,仅用于学习交流,转载需授权。













