诚然,金属植入物与人体之电化学腐蚀,或磨损,与局部和全身反应有关,学界对此问题之报道,最早见于1973年BMJ上Coleman等报道金属全髋关节置换后血和尿中钴和铬水平的升高,而指出铬在体内聚集的长远效应亟待研究[2]。1990年对于钛合金材料(钛-6铝-4钒Ti-6Al-4V)阳极氧化的报道[3]。
总体而言,金属植入物对人体之影响,分为局部和全身两大类。局部为金属周围组织内显微级金属颗粒,激活巨噬细胞而引起骨吸收和炎症反应。全身反应报道不多,牵涉金属溶解,随血液循环,聚集于终末器官。
如是,本文拟从关节、脊柱和儿童三方面加以阐述。
所有类型的股骨头-髋臼衬垫组合的人工髋关节置换术后,血清金属离子水平升高,较早见于1991年的报道[4]。近年来学界逐步关注金属离子升高之局部和全身效应。研究表明:局部组织反应,假瘤形成,全身效应,及肝、肾金属沉积[5],尤其是金属对金属全髋置换。
2004年,美国拉什大学的Urban等[5],对30例全髋关节置换患者肝脾标本,其中初次和翻修各15例。他们发现:肝脏和/或脾脏的巨噬细胞中查见亚微米级金属颗粒,其中翻修患者11/15例,初次置换患者2/15例。巨噬细胞局部聚集,无明显毒性。肝脾中金属颗粒聚集之长远效应,不得而知。
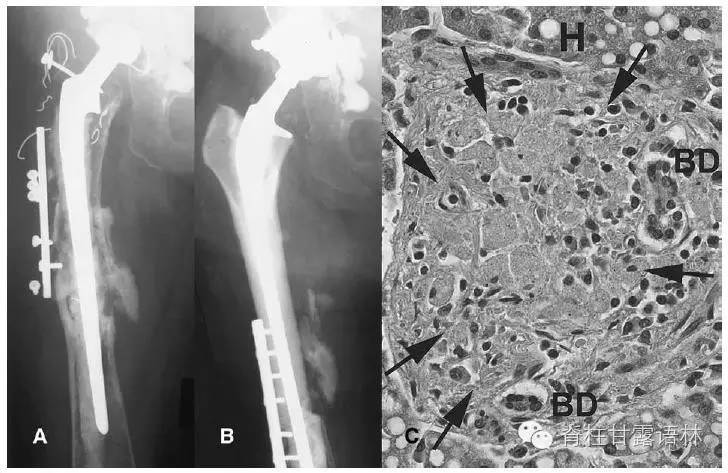
图1 女性91岁。(A)患者逝世前12年,术前影像,不锈钢髋关节假体周围骨折,假体松动。(B)翻修重建后10.5年。(C)肝脏尸检切片,巨噬细胞聚集(箭头),内含微小不锈钢金属颗粒。BD:胆小管。H:肝细胞(HE染色,放大300倍)
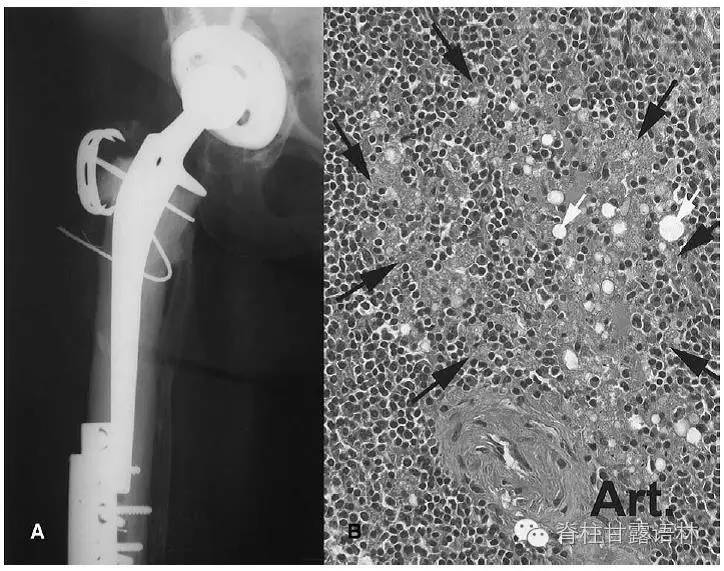
图2 女性,79岁。(A)逝世前1.7年髋关节X线片。(B)脾脏白髓切片,巨噬细胞聚集(黑色箭头),内含微小钴-铬-镍-钨颗粒。白色箭头为脂质小滴(HE染色,放大200倍)。
2013年,美国拉什大学骨科的Levine等,于JBJS上发表了全髋关节置换术后10年血中金属离子之经典文章[6],以高分辨扇形磁场电感耦合等离子体质谱法(HR-SF-ICP-MS)检测血中钴、铬和钛金属离子浓度,精度分别为0.04ng/mL,0.015ng/mL和0.2ng/mL。大关节置换后长期随访,血中钴、铬和钛金属离子浓度随时间(3年,5年,7年,8年,10年)而进行性增高,其中钛合金股骨柄之髋关节置换患者,10年时血钛浓度较术前增高18倍;其余两种材料的髋关节置换患者,血中钴、铬浓度增高近4倍。
模型研究中,钴和铬高浓度具有毒性,高水平钛潜在致癌[6]。然则,人体髋关节置换后血中金属离子升高的长远生理效应,尚不明确;金属离子产生毒性的正常上限,亦无统一标准。另一方面,人口的老龄化,关节置换患者数量亦增加。以是之故,这方面的研究亟待解决。
局部反应
1999年,美国加州大学的Wang等在Spine上报道了9例腰椎内固定融合而翻修的病例[11],组织取样后进行检测发现:假关节病例的组织内钛含量最高(30.36微克/每克干组织),牢固融合病例的钛含量低(0.586微克/每克干组织)。光镜下检测到软组织内金属颗粒,透射电镜下证实含有金属颗粒和次级溶酶体的巨噬细胞。
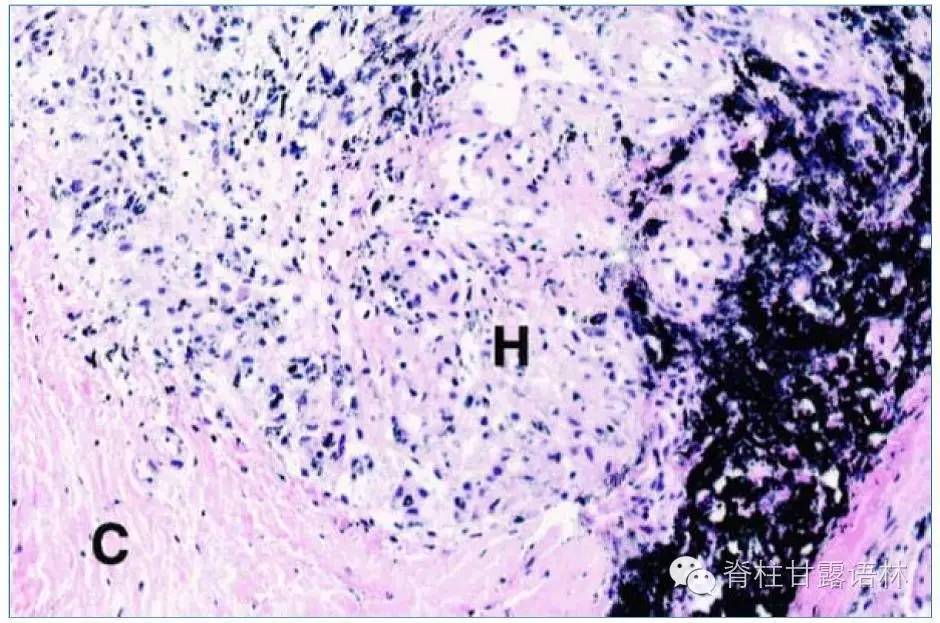
图3 椎旁组织的低倍显微镜下观。胶原基质C为巨噬细胞层H浸润,右侧可见黑色金属碎屑(HE染色,放大25倍)。
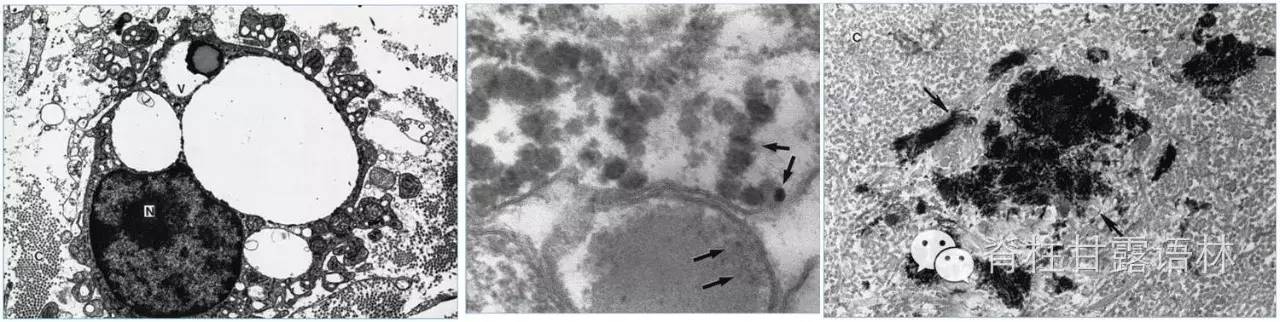
图4 透射电镜:左图:椎旁组织,胶原基质C中巨噬细胞,胞核N周围有透明空泡,其中V有次级溶酶体(放大5000倍);中图:高倍下(135000倍)电子致密颗粒,定量射线能谱分析为钛金属;右图:胶原基质中金属碎屑(箭头)(12000倍)。
全身反应
2003年,日本三重大学骨科Kasai等[7],研究了46例脊柱钛合金材料植入物的患者血和头发中钛和铝离子浓度(以相对古老的检测方法:放射广谱法,单位ppb)。他们发现,术后5.1年时,近三分之一(16例)患者血或头发中钛和铝离子异常增高。
2008年,美国南伊利诺大学Richardson等[8],于瑞典实验室以高分辨电感耦合等离子体质谱法(HR-ICP-MS)检测了30例钛合金内固定患者术后平均26月时血钛浓度,并与无金属内置物对照的13例患者加以对比,检测精度为0.25微克/L(ppm=1000ppb)。内固定为2组至4组钉棒系统,加或不加横连。结果发现:内固定患者(2.6微克/L,亦即2600ng/L)血钛浓度显著高于无内固定者(0.71微克/L,亦即710ng/L)。随内固定数量增多,血钛水平有所升高,椎间融合器与血钛水平显著升高有关(3.3 对 1.98微克/L)。
以上研究表明:脊柱钛合金内固定物降解之颗粒进入全身血液循环,平均钛金属水平与全髋关节置换患者体内金属水平相当。
颈椎人工椎间盘置入
2016年6月17日,Spine在线发表了圣路易斯骨科中心Gornet等的文章[1],阐述了颈椎人工椎间盘置换后血清金属水平。
人工颈椎间盘为金属-对-金属的钛合金/钛陶瓷成分,采用的检测方法为HR-ICP-MS,时间点为术前,术后3月,6月,12月,24月,36月,60月,84月。检测精度为0.2 ng/mL。
术前及术后各时间点血清钛浓度分别为:0.10,1.22, 1.15, 1.27, 1.21, 1.46, 1.34, and 1.42 ng/mL,术后任何时间点的浓度均显著高于术前。
整体而言,颈椎人工椎间盘置换后,患者体内血钛浓度亦增高,水平较后路内固定物和人工髋关节(钛合金为主的股骨柄和髋臼)低。
儿童和青少年体内金属浓度升高
2013年,澳洲阿德莱德大学Cundy等进行的前瞻性队列研究[9],纳入研究的对象为因脊柱侧弯或后凸行矫形的儿童和青少年,内固定为瑞士Synthes,成分为Ti6-Al7-Nb(6钛-7铝-铌),检测方法为HR-ICP-MS,精度分别为0.1,0.02和0.2 ppb(ng/L),时间点为术前,术后1周,1月,6月和12月。
该研究共检测32例患者,25例女性,平均年龄14.7岁(11.1-17.8岁),25例为青少年特发性脊柱侧弯。术后血钛和铌浓度明显高于术前,术后血钛浓度升高2.4倍,血铌浓度升高5.9倍。并于术后1周上升最快、最明显,维持至术后12月(图5)。
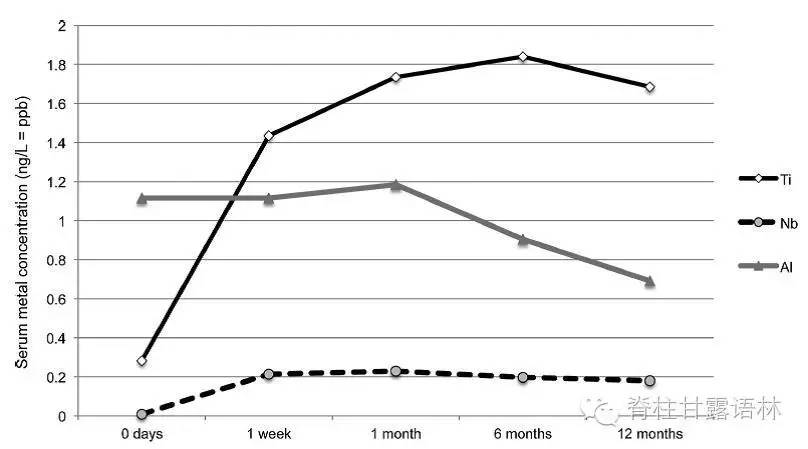
鉴于金属植入物要在儿童和青少年体内留存至少60年,血中高金属浓度的长远效应,虽不明确,但不容忽视。
儿童和青少年术后血金属水平与融合节段有关
2014年,澳洲研究团队对该前瞻性研究队列,又发布研究结果[10],依据内固定特征和内置物表面积SA与血中金属水平进行了深入分析。
术后血金属水平的预测因素包括:手术后时间,手术入路(后路或前路),融合节段(平均11个节段),置钉数量,固定棒数量,总金属表面积,总暴露金属表面积和总金属-对-金属表面积。
总体而言,融合节段越多,植入内固定越多,血中金属(钛和铌)水平越高。
越来越多的研究表明:金属植入人体后引起局部和全身反应,血中金属离子的增高,器官的沉积,所引起的长远效应,血中金属离子的正常上限,都亟待界定。尤其对于儿童和青少年脊柱畸形患者,多节段内固定且终身留存。
从1973年BMJ上报道血尿中金属离子增高至今,近50年;人体中水占很大部分,儿童和青少年则更多,与金属之间的化学反应似乎不容忽视。
这些问题,亟待学界加以研究界定。
Gornet MF, Singh V, Schranck FW, Skipor AK, Jacobs JJ. Serum Metal Concentrationsin Subjects with Titanium Ceramic Composite Cervical Disc Replacements. Spine(Phila Pa 1976). 2016 Jun 17. [Epub ahead of print] PubMed PMID: 27323223
Coleman RF, Herrington J, Scales JT. Concentration of wear productsin hair, blood, and urine after total hip replacement. BMJ 1973;1:527–9.
Cigada A, Cabrini M, Pedeferri P. Increasing of the corrosionresistance of the Ti6Al4V alloy by high thickness anodic oxidation. Int J ArtifOrgans 1990;13:585–7.
Jacobs JJ, Skipor AK, Black J, Urban R, Galante JO. Release and excretionof metal in patients who have a total hip-replacement component made oftitanium-base alloy. J Bone Joint Surg Am. 1991;73(10): 1475-86.
Urban RM, Tomlinson MJ, Hall DJ, Jacobs JJ. Accumulation in liverand spleen of metal particles generated at nonbearing surfaces in hiparthroplasty. J Arthroplasty. 2004; 19(8)(Suppl 3):94-101.
Levine BR, Hsu AR, Skipor AK, Hallab NJ, Paprosky WG, Galante JO,Jacobs JJ. Ten-year outcome of serum metal ion levels after primary total hiparthroplasty: a concise follow-up of a previous report*. J Bone Joint Surg Am.2013 Mar 20;95(6):512-8. doi: 10.2106/JBJS.L.00471. PubMed PMID: 23515985;PubMed Central PMCID: PMC3748974.
Kasai Y, Iida R, Uchida A. Metal concentrations in the serum andhair of patients with titanium alloy spinal implants. Spine (Phila Pa 1976).2003 Jun 15;28(12):1320-6. PubMed PMID: 12811278.
Richardson TD, Pineda SJ, Strenge KB, Van Fleet TA, MacGregor M,Milbrandt JC, Espinosa JA, Freitag P. Serum titanium levels after instrumentedspinal arthrodesis. Spine (Phila Pa 1976). 2008 Apr 1;33(7):792-6. doi:10.1097/BRS.0b013e318169574d.PubMed PMID: 18379407.
Cundy TP, Antoniou G,Sutherland LM, Freeman BJ, Cundy PJ. Serum titanium, niobium, and aluminumlevels after instrumented spinal arthrodesis in children. Spine (Phila Pa1976). 2013 Apr 1;38(7):564-70. doi: 10.1097/BRS.0b013e3182741961. PubMed PMID:22996267.
Cundy TP, Cundy WJ, AntoniouG, Sutherland LM, Freeman BJ, Cundy PJ. Serum titanium, niobium and aluminiumlevels two years following instrumented spinal fusion in children: does implantsurface area predict serum metal ion levels? Eur Spine J. 2014Nov;23(11):2393-2400. PubMed PMID: 24659389.
Wang JC, Yu WD, Sandhu HS,Betts F, Bhuta S, Delamarter RB. Metal debris from titanium spinal implants.Spine (Phila Pa 1976). 1999 May 1;24(9):899-903. PubMedPMID: 10327512.
本文来源:“脊柱甘露语林”微信平台(jzglyl)
作 者:王海强 张军













