
2020年全球最新癌症数据显示,乳腺癌发病率已跃居榜首,成为全球第一大癌症。其中,三阴性乳腺癌(TNBC)由于缺少激素受体(HR)、人表皮生长因子受体2(HER2)等特异性治疗靶点,仍以蒽环、紫杉类、铂类等传统化疗方案为主,复发转移阶段疗效不如人意,患者整体预后欠佳。
随着单克隆抗体研发的突飞猛进,具有百年历史的“魔术子弹”概念终成现实,抗体药物偶联物(ADC)凭借靶向药的精准和化疗药的高效,切实提高了抗肿瘤治疗的获益风险比,成为肿瘤治疗领域的焦点。其中,以人类滋养层细胞表面抗原2(TROP-2,又称肿瘤相关钙信号转导蛋白2)为靶点的ADC药物戈沙妥组单抗(Trodelvy:registered:,sacituzumab govitecan-hziy,研发代码IMMU-132)在晚期TNBC治疗的探索中脱颖而出,其Ⅰ/Ⅱ期临床研究和Ⅲ期ASCENT研究先后登顶国际权威学术期刊《新英格兰医学杂志》(N Engl J Med)1-2 ,并凭借显著疗效在一年内先后得到美国食品药品管理局(FDA)加速批准与完全批准,用于既往接受过至少2种系统治疗(其中至少1种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌患者。此外,戈沙妥组单抗在被纳入《中国晚期乳腺癌规范诊疗指南(2020版)》的同时,其国内上市的相关临床试验也在积极进展中3。作为全球首个获批治疗TNBC的TROP-2靶点ADC药物,戈沙妥组单抗实现了TNBC治疗格局的新突破,开启了TNBC精准治疗的新篇章,为众多患者带来了新希望。
戈沙妥组单抗(sacituzumab govitecan-hziy)由美国Immunomedics公司(现为吉利德科学公司的一部分)研发,由云顶新耀公司将该药引入国内开展相关临床试验,云顶新耀在大中华区、韩国和部分东南亚国家对戈沙妥组单抗的所有癌症适应症拥有研发、注册和商业化的权益。
追本溯源,创新引领
聚焦TROP-2靶点强势破局而出
TROP-2是一种最初在人滋养层细胞中发现的细胞表面糖蛋白,在胚胎器官的发育过程中具有重要作用。值得注意的是,TROP-2也参与恶性肿瘤的发生、侵袭和转移,其在人体正常组织中不表达或低表达,但高表达于乳腺癌、胰腺癌、结肠癌、胃癌、食管鳞癌、宫颈癌、卵巢癌等多种恶性肿瘤中。并且,其高表达与肿瘤患者生存期缩短及不良预后密切相关4。因此,近年来以TROP-2为靶点的分子靶向药物已成为肿瘤领域备受关注的研究热点。
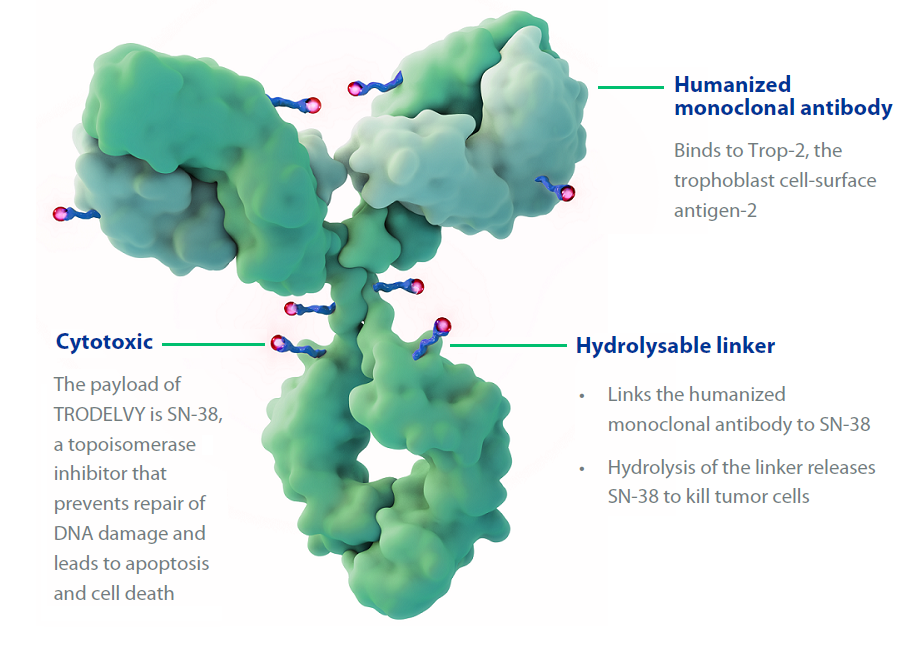
图1:戈沙妥组单抗示意图(图源https://www.trodelvy.com/)
作为全球首创且唯一获批治疗TNBC的TROP-2靶点ADC药物,戈沙妥组单抗是TROP-2的人源化单克隆抗体hRS7 IgG1κ与伊立替康活性代谢物SN-38(拓扑异构酶I抑制剂)的偶联物。药物/抗体比(DAR)是ADC药物抗体所连接药物数量的平均值,对药效有重要影响。以往ADC药物的DAR为3~4,戈沙妥组单抗通过连接体结构的优化一举打破传统,将DAR提升至7.6,在保证药物稳定性的同时,大幅提升了药物疗效。
由于TROP-2在90%以上的TNBC中表达5,戈沙妥组单抗的临床应用几乎无需进行靶点检测。TROP-2抗体与SN-38偶联而成的ADC药物不仅能够借助TROP-2抗体使SN-38靶向精准地作用于肿瘤细胞,而且能够进一步提高肿瘤细胞内SN-38的药物浓度,发挥高效抗肿瘤特性,与此同时,还能够降低全身不良反应发生率6。戈沙妥组单抗兼具精准高效的优越特性和良好的治疗安全性,不仅有望破局TNBC治疗困境,而且在更多瘤种的治疗领域潜力巨大。
实力出众,屡获佳绩
荣登顶级医学期刊并成功落地临床
2019年,国际顶级医学权威期刊《新英格兰医学杂志》发表了全球第一项ADC单药治疗晚期TNBC的前瞻性临床试验——IMMU-132-01研究的重磅成果。这项Ⅰ/Ⅱ期单臂、多中心临床研究纳入了108例既往至少接受过两种系统性治疗的转移性TNBC患者,疗效结果显示,戈沙妥组单抗单药治疗的客观缓解率(ORR)为33.3%,中位持续缓解时间(DoR)为7.7个月,临床获益率达45.4%,中位无进展生存(PFS)为5.5个月,中位总生存(OS)达13.0个月。安全性方面,最常见的不良反应为血液学和消化道事件,可通过减量和药物治疗加以管理,仅约5%的患者因治疗相关不良事件(AE)而停药。基于上述数据,2020年4月戈沙妥组单抗获得FDA的加速批准,成为首个用于TNBC的ADC药物。
虽然戈沙妥组单抗Ⅰ/Ⅱ期临床研究缺乏有效对照组,但研究成果振奋人心,也为晚期TNBC的精准治疗的探索开辟了全新的方向。2021年4月22日,戈沙妥组单抗凭借确认性Ⅲ期ASCENT研究的不凡结果再度登顶《新英格兰医学杂志》,这项随机对照Ⅲ期临床研究进一步对比了戈沙妥组单抗与化疗在晚期TNBC患者中的疗效及安全性,结果再次力证了戈沙妥组单抗治疗TNBC的优越性。
ASCENT研究是一项国际多中心、开放标签、随机对照Ⅲ期临床试验,研究的入组标准为:1)根据《美国临床肿瘤学会(ASCO)/美国病理学家协会(CAP)乳腺癌激素受体免疫组化检测指南》,TNBC诊断明确;2)既往至少接受过两种系统性治疗、难治或复发的局部晚期或转移性乳腺癌患者;3)既往接受过紫杉类药物化疗。患者经1:1随机分组接受戈沙妥组单抗(10 mg/kg,治疗周期的第1天和第8天,每21天为一个治疗周期)单药静脉滴注,或接受单药化疗(艾立布林、长春瑞滨、卡培他滨、吉西他滨),直至疾病进展、毒性不可耐受、患者撤销知情同意或死亡。研究的主要终点是根据RECIST 1.1标准评估的无脑转移患者的PFS,次要终点包括OS、ORR和安全性。
截至2019年9月,研究共纳入468例无脑转移患者,随机接受戈沙妥组单抗(n=235)或化疗(n=233),中位随访时间为17.7个月。结果显示,戈沙妥组单抗较化疗显著延长了mPFS(5.6个月 对 1.7个月),降低进展或死亡风险59%(HR= 0.41);显著延长了mOS(12.1个月 对 6.7个月),降低总死亡风险52%(HR=0.48);同时提高了ORR(35% 对 5%)。
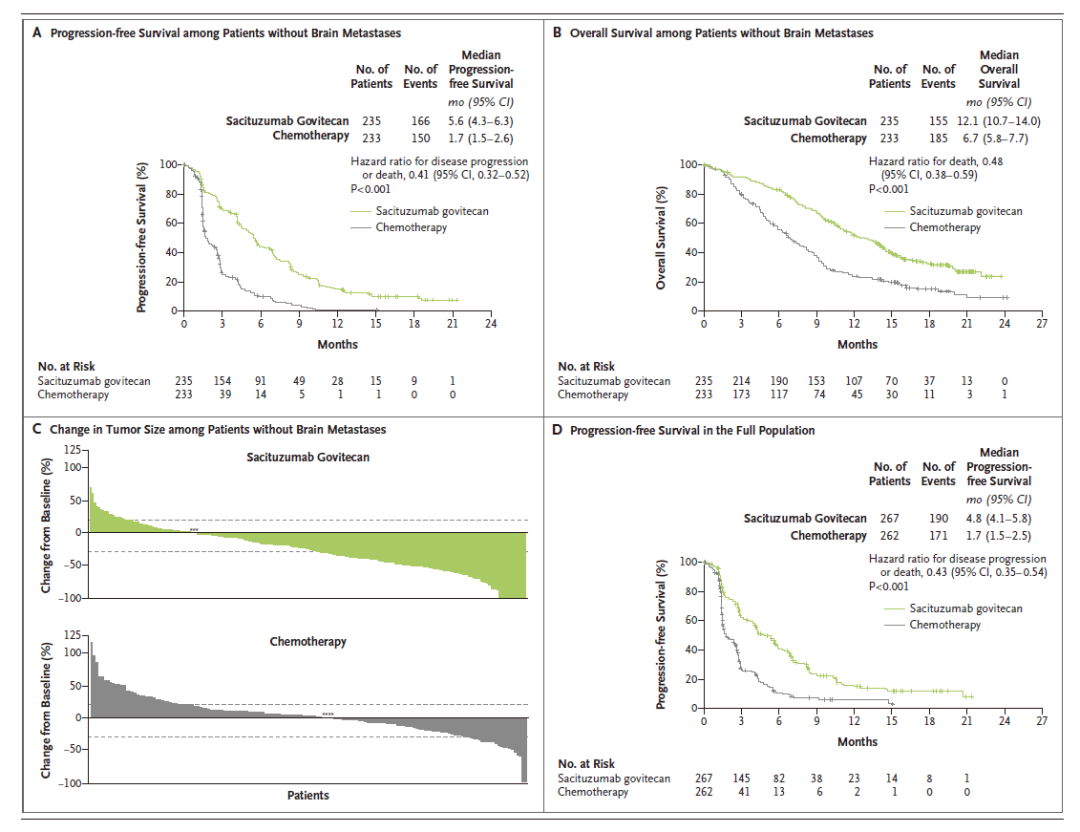
图2:ASCENT研究PFS及OS数据(图源参考文献2)
亚组分析进一步显示,无论患者年龄、种族、既往治疗方案数量、地理区域、既往是否接受过PD-1/PD-L1抑制剂治疗、有无肝转移、初诊是否为TNBC,与化疗相比,戈沙妥组单抗均能带来显著PFS获益。
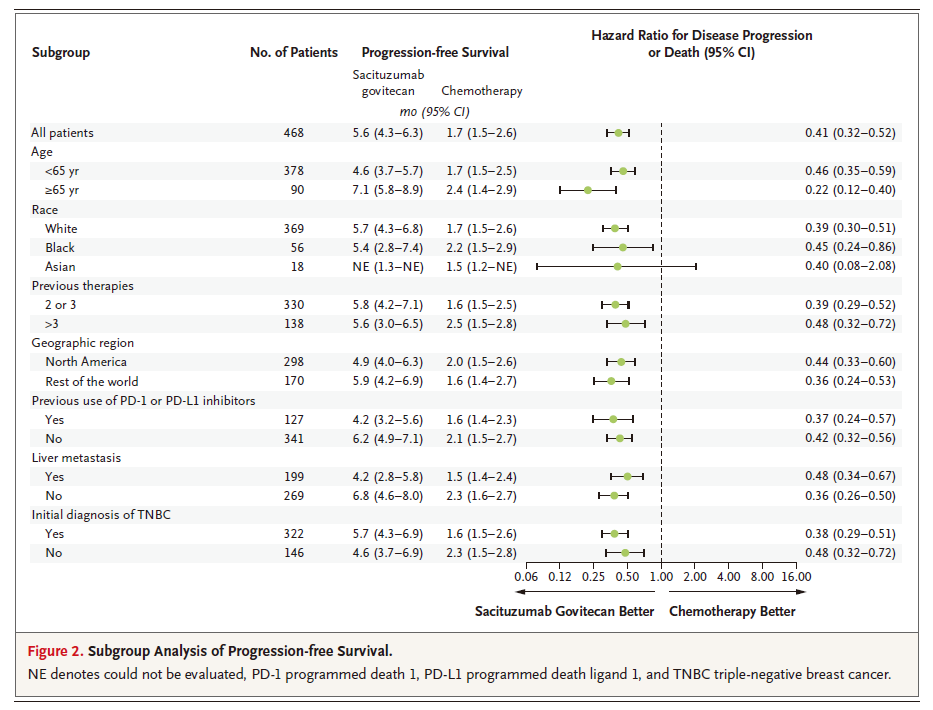
图3:ASCENT研究亚组分析数据(图源参考文献2)
安全性方面,戈沙妥组单抗与化疗常见的3级及以上AE发生率分别为:中性粒细胞减少(51% 对 33%)、白细胞减少(10% 对 5%)、腹泻(10% 对 1%)、贫血(8% 对 5%)、粒细胞减少性发热(6% 对 2%)。未观察到因戈沙妥组单抗治疗所致的相关死亡事件,但观察到3例因化疗AE所致的死亡事件。
研究结果显示,与化疗相比,戈沙妥组单抗能够显著延长接受过至少两种或以上既往治疗的局部晚期或者转移性TNBC患者PFS和OS。戈沙妥组单抗治疗的骨髓抑制和腹泻发生率较高,总体安全可控。
全面布局,探索不止
深挖药物潜力普惠更多患者
目前,戈沙妥组单抗在我国人群中开展的针对“接受过至少两种既往治疗的转移性TNBC患者”的Ⅱb期临床试验也在积极进展中。除了TNBC治疗领域外,经国家药品监督管理局药品审评中心(CDE)批准,戈沙妥组单抗治疗HR阳性/HER2阴性转移性乳腺癌的临床试验亦在国内同步开展。
图4:CDE公示戈沙妥组单抗临床试验获批信息(图源http://www.chinadrugtrials.org.cn/)
与此同时,戈沙妥组单抗进军更广泛瘤种的探索步伐从未停止。今年4月,FDA又批准戈沙妥组单抗用于治疗既往接受过含铂化疗,以及PD-1或PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌(mUC)患者;目前,戈沙妥组单抗治疗mUC的中国Ⅲ期临床研究也已获得CDE批准,正在顺利实施中。此外,CDE还批准了戈沙妥组单抗治疗多种TROP-2高表达肿瘤Ⅱ期篮式试验的申请,这一新颖疗法在复发/难治性食管鳞癌、胃癌和宫颈癌中的表现令人期待。展望未来,相信在各领域内专家学者的共同努力下,通过更广泛的布局和更深入的研究能够进一步挖掘戈沙妥组单抗的治疗潜力,为更多肿瘤患者带来新的获益。













