
病理诊断是指通过手术切除、内镜活检、细针穿刺等方式获取人体组织或细胞,借助显微镜等工具对样本进行一系列处理和观察,研究疾病病因、发病机制、形态结构、功能和代谢等方面的改变,揭示疾病的发生发展规律,从而阐明疾病本质的医学科学,是绝大部分疾病,尤其是肿瘤疾病的诊断“金标准”。
病理诊断流程主要包含取样、制片、诊断、报告四个步骤。
所有标本应及时、充分固定:10%甲醛溶液(中性缓冲福尔马林)固定液,活检标本应立即固定,手术切除标本尽可能半小时内固定,建议在病理申请单或相应的信息系统上记录标本离体时间和固定时间,以备查询。固定液应超过标本体积的10倍以上。
标本离体后,应由内镜医师展平,平贴在滤纸上,立即放入固定液中固定。活检黏膜全部取材,应将黏膜包于滤纸中以免丢失。取材时应滴加伊红,利于包埋和切片时技术员辨认。包埋时需注意要将展平的黏膜立埋。
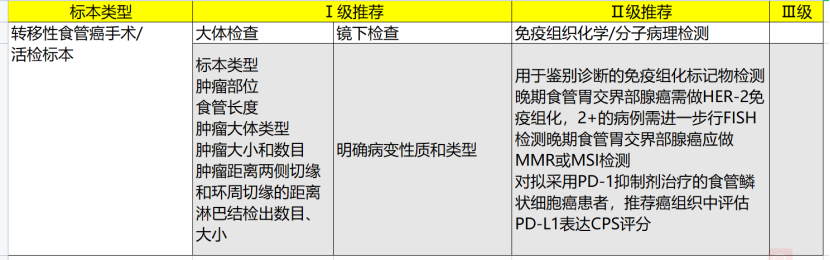
内镜下黏膜切除术(EMR)/内镜下黏膜下剥离术(ESD)标本:应由内镜医师展平标本,黏膜面向上,固定于软木板(或泡沫板)上,标记口侧及肛侧方向,立即完全浸入足量固定液中,测量并记录标本大小(最大径?最小径?厚度),食管胃交界部标本要分别测量食管和胃的长度和宽度。记录黏膜表面的颜色,是否有肉眼可见的明显病变,病变的轮廓是否规则,有无明显隆起或凹陷,有无糜烂或溃疡等,记录病变大小(最大径?最小径?厚度)、大体分型以及病变距各切缘的距离(至少记录病变与黏膜侧切缘的最小距离)。
多块切除的标本宜由手术医师根据内镜下病变的轮廓/碘不染色轮廓(食管鳞状上皮病变)在标本固定前进行重建。应全部取材。宜涂碘识别病变(碘不染色区)和最近侧切缘,垂直于最近侧切缘取材。黏膜侧切缘与基底切缘宜用不同颜色的墨汁或染料标记。食管胃交界部标本宜沿口侧-肛侧的方向取材。每间隔2-3mm平行切开,全部取材,按同一方向立埋。记录组织块对应的部位。建议将多块切除的标本分别编号和取材,不需考虑侧切缘的情况。
根治术标本:沿肿瘤对侧打开食管璧。黏膜面向上,固定于软木板(或泡沫板)上,立即完全浸入足量固定液中。取材时记录切除食管长度、肿瘤部位、肿瘤距口侧切缘和肛侧切缘及环周切缘的距离、肿瘤大体分型、大小、切面颜色、质地、浸润深度、累及/未累及食管胃交界部(累及食管胃交界部者,记录肿瘤中心距食管胃交界部的距离)、肿瘤旁或肿瘤周围食管黏膜/肌壁检查所见。食管胃交界部腺癌建议采用Siewert分型。取材必要时涂碘识别病变(碘不染色区),食管取材可自肿瘤中心从口侧切缘至肛侧切缘取一条组织分块包埋(包括肿瘤、肿瘤旁黏膜及两端切缘),并记录组织块对应的方位(宜附照片或示意图并做好标记),推荐纵向取两端切缘与肿瘤的关系,对肿瘤距两端切缘较远者,也可横向取两端切缘。单独送检的闭合器切缘应剔除闭合器后全部取材观察。对肿瘤侵犯最深处及可疑环周切缘受累处应重点取材。推荐使用墨汁或染料标记环周切缘。对周围黏膜糜烂、粗糙或碘不染色等改变的区域或周围食管/胃壁内结节及食管胃交界部组织应分别取材。若附纵隔胸膜、肺和膈肌等其他邻近器官应观察取材。对早期食管癌或新辅助治疗后根治术标本,建议将可疑病变区和瘤床全部取材。
环周切缘是指食管的基底切缘,食管全周均没有浆膜覆盖。环周切缘阳性是指环周切缘有肿瘤,建议用0、0-0.1cm及≥0.1cm注明肿瘤距环周切缘的距离。
送检的分组淋巴结应全部包埋取材。标准的二野或三野清扫且未经新辅助治疗的根治术标本应检出15枚以上淋巴结。若第一次未找到15枚淋巴结,建议复检。
食管癌的癌前病变包括鳞状细胞癌的癌前病变和腺癌的癌前病变,即鳞状上皮和腺上皮的上皮内瘤变/异型增生。上皮内瘤变和异型增生两个名词可通用。鳞状上皮的上皮内瘤变/异型增主是指以食管黏膜鳞状上皮内不同层次的异型鳞状细胞为特征的癌前病变,根据病变累及层次,分为低级别上皮内瘤变/异型增生(局限于鳞状上皮下1/2),高级别上皮内瘤变/异型增生(累及食管鳞状上皮超过下1/2。腺上皮的上皮内瘤变/异型增生是指以食管腺上皮不同程度的细胞异型性和结构异常为特征的癌前病变,主要见于Barrett食管,根据细胞异型性和结构异常的程度,分为低级别上皮内瘤变/异型增生和高级别上皮内瘤变/异型增生。
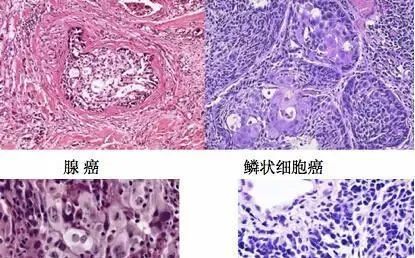
组织学分级:鳞状细胞癌和腺癌依据分化程度分为高分化、中分化和低分化。
对于黏膜下层浸润癌,如为内镜下切除标本,应测量黏膜下层浸涧深度(um),超过200m的转移风险高,需补充食管切除+淋巴结清扫术或放化疗。
脉管侵犯:淋巴管/血管设润(尤其是对于内镜下切除标本,如果怀疑有淋巴管/血管浸润,建议做免疫组化CD31、D2-40确定是否有淋巴管/血管浸润;弹性纤维染色判断有无静脉侵犯)。
食管癌分期采用美国癌症联合会(AJCC)TNM分期第8版。若肿瘤累及食管胃交界部,肿瘤中心在食管胃交界部食管侧者或在胃侧2cm之内者(Siewert分型Ⅰ型和Ⅱ型),按食管癌分期;肿瘤中心在近端胃2cm之外(Siewert分型Ⅲ型)按胃癌分期。肿瘤中心虽在近端胃2cm之内但未累及食管胃交界部者,按胃癌分期。TNM前加前缀p、c、r和y,分别代表病理分期、临床分期、复发性肿瘤分期和治疗后肿瘤分期。T后加后缀m或病灶的具体数目代表多发性原发肿瘤的分期。
新辅助治疗后根治术标本的病理学评估:食管癌的疗效分级系统宜采用CAP(College of American Pathologists)NCCN(The National Comprehensive Cancer Network)指南的标准。
根据鉴别目标选取,食管鳞状细胞瘤典型的免疫表型为CK5&6+/P40+/P63+,食管小细胞癌典型的免疫表型为Syn+/ChrA+/CKS&6-/P40-/P63-。
食管胃交界部腺癌是橫跨解剖学上食管胃交界部的腺癌。解剖学上食管胃交界部是指管状食管变为囊状胃的部位,即食管末端和胃的起始,相当于腹膜返折水平或希氏角或食管括约肌下缘,与组织学上的鳞柱交界不一定一致。
错配修复(MMR)蛋白的检测:免疫组织化学方法检测4个常见MMR蛋白(MLHI,MSH2、MSH6和PMS2)的表达,阳性表达定位于细胞核。任何一个蛋白表达缺失为dMMR(错配修复功能缺陷),所有4个蛋白表达均阳性为pMMR(错配修复功能完整)。
微卫星不稳定(MSI):建议采用美国国家癌症研究院(NCI)推荐的5个微卫星(MS)检测位点(BAT25,BAT26,D5S346,D2S123和D17S250),判断标准为三级:所有5个位点均稳定为MSS(微卫星稳定),1个位点不稳定为MSI-L(微卫星低度不稳定),2个及2个以上位点不稳定为MSI-H(微卫星高度不稳定),MSI多由MMR基因突变及功能缺失所致,也可以通过检测MMR蛋白缺失来反映MSI状态。一般而言,dMMR相当于MSI-H,pMMR相当于MSI-L或MSS。
对拟采用PD-1抑制剂治疗的食管鳞状细胞癌患者,推荐癌组织中评估PD-L1表达CPS评分。PD-L1(22C3)检测试剂盒已经获批用于食管鳞状细胞癌,作为帕博利珠单抗治疗的伴随诊断,以CPS ≥10作为阳性标准。
-----------END--------------
声明:本文由肿瘤学院作者整理,如有侵权请联系删除,转载需授权。













