
随着分子病理检测技术及研究领域的迅猛发展,肾细胞癌的分类及诊疗方案也在快速演变。近年来涌现了很多新的肾细胞癌类型,对已知类型的认识也得到了极大的发展。目前在大多数的肾细胞癌中存在分子遗传学异常,表现为染色体数目、结构异常或相关基因突变、扩增以及因染色体易位产生融合基因等。这些分子遗传学异常的发现,不仅可以协助肾细胞癌确诊、分型,还在预后判断及分子靶向治疗方面有着重要的参考价值。目前批准用于转移性透明细胞性肾细胞癌(ccRCC)的靶向药物有6大类13个药品,分别为VEGFR、mTORC1、c-MET和FGFR抑制剂、细胞因子和抗PD1/PDL1免疫检查点抑制剂[1]。
在过去的10年中,这些药物成功将转移性ccRCC患者中位生存期从15个月增加到30个月[1]。然而不同患者和药物之间,药效差异明显,提示药物作用机制、肿瘤分子遗传学改变和宿主肿瘤-免疫相互作用存在明显异质性,亦突显出精准治疗的重要性。随着癌症基因组图谱的逐渐明晰,分子病理检测技术的成熟和推广,病理医师可以有机会对肿瘤个体基因层面有一个全面的认识和理解,揭开了泛组学精准诊疗的时代序幕。国际泌尿病理协会(ISUP)在2019年召开了泌尿男生殖系统肿瘤分子病理学共识会议[2]。
本文参考了该会议中肾癌工作组的建议,并结合国内外最新研究进展以及国内泌尿男生殖病理学组专家意见,重点介绍肾细胞癌分子病理学的最新进展及应用,供国内病理同仁们理解和参考。

WHO分类已列出的肿瘤类型
:arrow_forward: 透明细胞性肾细胞癌(ccRCC)
ccRCC是成人肾脏肿瘤中最常见的类型,占肾脏肿瘤的65%~70%[3]。3号染色体短臂(3p)上相关基因的分子改变,尤其是Von Hippel-Lindau (VHL)基因改变,是ccRCC最经典的早期分子遗传学特征。往往第一次肿瘤致病打击来自VHL基因的改变(基因突变或启动子区甲基化),随后发生“二次打击”即3p大片段缺失,从而导致肿瘤发生。若全面开展突变、拷贝数变异及甲基化检测的实验方法,超过90%的ccRCC都能找到3p改变[2]。因此,在临床工作中,病理医师可以通过荧光原位杂交(FISH)方法检测3p缺失来辅助诊断ccRCC。
此外,还有一些位于3p的基因在ccRCC中频繁发生突变,如SETD2、BAP1、PBRM1等,不少基因功能与染色质重塑相关[4, 5]。其中SETD2、BAP1突变的病例与不良预后相关,而PBRM1突变的病例与预后的关系尚存在争议。目前,临床工作中并不常规检测上述基因状态,然而随着分子病理学的发展成熟,上述基因的作用可能会更加明朗。
碳酸酐酶Ⅸ(CAⅨ)是临床工作中用于辅助诊断ccRCC的一个很有效的免疫组织化学指标,在分化好的ccRCC中通常呈现弥漫性膜阳性染色(在侵袭性或分化差的ccRCC中着色可能减弱)。其阳性表达的机制是:CAⅨ是位于VHL基因下游的缺氧诱导通路上的一个组成部分。因此CAⅨ免疫组织化学检测可看作是ccRCC分子检测的便捷替代品。但在应用这个抗体的同时,需要注意其他一些情况:
首先,CAⅨ在非肾脏肿瘤中可以阳性表达,故在考虑原发灶不明的转移癌的起源部位时,尤其是在无明显肾脏肿块或肾癌病史的患者中,应谨慎解读;其次,由于CAⅨ是缺氧诱导通路的一部分,在任何缺氧或局部缺血的肿瘤或组织中都可能出现某种程度的阳性着色,尤其是在活检标本或坏死明显而存活细胞有限的肿瘤标本中;最后,ccRCC虽然通常不存在VHL基因改变,但一致性的表达CAⅨ标志物,CAⅨ“杯状阳性”表达模式被认为是透明细胞乳头状肾细胞癌的特征之一[2]。
专家组建议要点:
1.在诊断困难的情况下(尤其是小活检标本或表现为高级别特征而无典型的低级别ccRCC成分以及出现在转移部位时),分子病理检测可用于辅助ccRCC的诊断,例如染色体3p缺失(FISH,细胞遗传学或拷贝数分析)或VHL基因突变分析,但需注意3p缺失在ccRCC中并不是绝对特异,在VHL综合征相关的其他种瘤中都可以存在缺失,如肾囊肿以及中枢神经系统血管母细胞瘤、胰腺囊肿和神经内分泌肿瘤、内耳淋巴囊瘤等,其中一些肾外肿瘤亦表现为透明细胞肿瘤,不能依据3p缺失就认为是ccRCC转移。此外,基于分子遗传学检测手段和方法的差异,并不是所有3p改变都能被检出,而且少数ccRCC无3p改变,因此在典型的临床病理和免疫表型特征下,3p无缺失并不能除外ccRCC。
2.对于可明确诊断的ccRCC病例,无需常规使用分子病理学方法,需要利用分子病理技术时,最优选的分子检测手段是用FISH检测3p缺失。
3. CAⅨ免疫组织化学标记在大多数情况下可以用作ccRCC分子病理检测的替代;但需注意,在非肾肿瘤、其他肾细胞癌(RCC)伴有组织缺氧和坏死灶的周围以及透明细胞乳头状肾细胞癌中也可以观察到CAⅨ阳性着色。
:arrow_forward: 乳头状肾细胞癌(pRCC)
pRCC是第二大常见的肾细胞癌类型,占成人肾癌的15%~19%。传统上根据核级别以及细胞排列层次将其划分为2种亚型(1型和2型pRCC)[3]。1型pRCC具有稳定的形态学、免疫表型和分子遗传学特征,一致性较好;而2型pRCC形态学异质性较大、分子遗传学特征复杂,可能包含不止一种类型。虽然在pRCC中分子分型的诊断作用和临床治疗意义尚未确定,但是目前新近的研究表明,除了传统意义上区分的两种亚型pRCC,还存在更多的亚型。
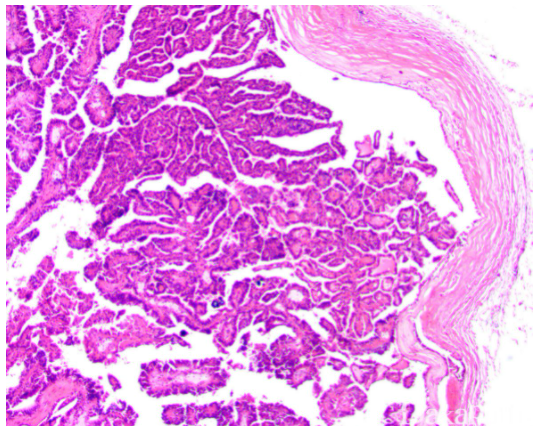
1型pRCC涉及多种染色体异常,其中7号、17号染色体的多倍体或三倍体改变是最常见的分子特征;其余还包括3、12、16和20号以及相对少见的2、4、5、6、8、13和18号染色体获得,1、2、4、5、7、8、9、10、11、14、15、16、18、19、20、21和22号染色体缺失。此外,遗传性pRCC综合征常表现为多灶性1型pRCC,以位于7q31的MET原癌基因常染色体显性胚系突变为特征,伴有MET通路激活。在散发性病例中也会存在MET基因突变,但其突变频率要明显低于具有遗传背景的pRCC。在其他类型散发性肿瘤中还可见到MET基因扩增,并且在具有突变或扩增的肿瘤中也报道了靶向MET治疗的潜在作用[3]。
目前,诊断的2型pRCC是一组异质性较大的肿瘤。尽管以前认为7号和17号染色体获得在2型pRCC中较为常见,但是在近年来的研究却发现这种异常所占比例较小。涉及12、16及20号染色体获得现象也存在于2型pRCC中。此外,新近的癌症基因组图谱发现2型pRCC具有CDKN2A基因沉默、SETD2基因突变等改变,并且常伴有NRF2-ARE通路的表达上调[6]。在以往诊断的少数所谓2型PRCC中还发现了CpG岛甲基化表型,其与FH基因突变及mRNA表达下降高度相关,提示其实质上是一种新的肾癌类型——遗传性平滑肌瘤病和肾细胞癌综合征相关性肾细胞癌(hereditary leiomyomatosis and renal cell carcinoma-associated renal cell carcinoma,HLRCC-RCC)/FH缺陷型肾细胞癌(见后文)。
嗜酸细胞型pRCC被认为是pRCC的第三种亚型,2016版WHO中亦单独提出此亚型,描述其“胞质丰富、细颗粒状,细胞核通常低级别,类似肾嗜酸细胞瘤(renal oncocytoma,RO)细胞核样,单层、线性排列”[3]。但由于文献中对于这类pRCC的定义模糊,尚未就此类亚型达成诊断的明确共识。新近的研究表明,如果按照严格的标准进行定义,则在称之为嗜酸细胞型pRCC中应区分出一类独特的亚型。在Saleeb等[7]对pRCC的分类方案中,该亚型被认为是4型pRCC(低级别嗜酸性),而最近Al-Obaidy等[8]提出以“伴有核极向倒置特征的乳头状肾肿瘤(papillary renal cell neoplasm with reverse polarity)”来命名此种亚型,由于该亚型目前报道的病例均呈现惰性的生物学行为,未出现复发和转移,因此暂未定义它是否是一种pRCC,而是描述为“papillary renal cell neoplasm”。该亚型由单层乳头状结构组成,胞质丰富呈嗜酸性,并且细胞核特征性的朝向细胞的顶端排列。免疫表型方面,伴有核极向倒置特征的乳头状肾肿瘤一致的强阳性表达GATA3。此外,该类肿瘤具有KRAS突变的分子遗传学特征,这与传统意义上的2种亚型的pRCC明显不同,是一种新提出的诊断类型。
专家组建议要点:
1.1型pRCC是诊断最统一的亚型,通常可根据形态学诊断。对于疑难病例可通过7和17号染色体获得现象以及CK7阳性的特点辅助判断。实践诊断过程中最优选的分子检测手段是用FISH方法检测7号和17号染色体倍数。
2.2型pRCC在临床病理学及分子遗传学特征方面均具有异质性,因此在诊断2型pRCC时需谨慎,特别是需要排除FH缺陷型肾细胞癌。
3.伴有核极向倒置特征的乳头状肾肿瘤是一种新提出的肿瘤类型,可根据特征性的形态学表现(细胞核特征性的朝向细胞的顶端排列)、免疫表型(GATA3强阳性表达)及分子遗传学改变(KRAS突变)进行诊断。
4.在PRCC各亚型中AMACR(P504s)大多高表达,因此该抗体对PRCC的诊断具有辅助作用(注:尽管AMACR在PRCC中通常强阳性表达,但在其他多种类型的肾癌也可以表达,如FH缺陷型肾癌、获得性囊性肾病相关性肾癌等,因此该抗体对于PRCC的诊断特异性并不强)。
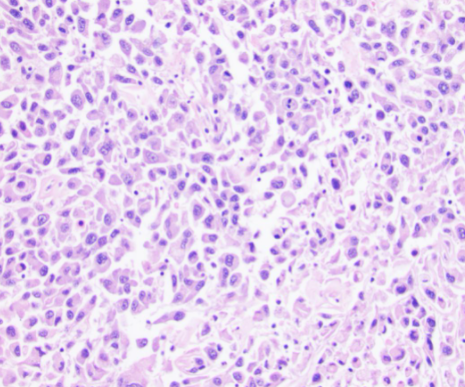
:arrow_forward: 嫌色细胞性肾细胞癌(chRCC)
chRCC也是一种常见的肾脏肿瘤,生物学行为较为惰性,经典的形态学特征是:肿瘤由2种细胞构成,嫌色细胞体积较大,胞质苍白,胞膜清晰,呈“植物细胞样”,另一种嗜酸细胞体积较小,肿瘤细胞的胞膜明显,细胞核皱缩呈葡萄干样,常可见核周空晕。研究中报道chRCC存在一些分子遗传学改变,如多个染色体丢失(Y,1、2、6、10、13、17、21号染色体最常见),以及TP53、PTEN、TERT基因的改变[3],但这些改变对chRCC的诊断并不特异,因此对疑难病例,即使行分子检测也不能作为确诊依据,实践中较少需要用到分子病理手段去诊断chRCC。当怀疑与Birt-Hogg-Dubé综合征相关的杂交瘤时,可检测FLCN基因突变辅助诊断。
专家组建议要点:
1. chRCC通常可以根据典型的组织学特征辅以免疫表型明确诊断。
2. 在疑难病例中,可以考虑检测肿瘤染色体拷贝数做辅助诊断,chRCC最常见改变为多条染色体的丢失(Y,1、2、6、10、13、17、21号染色体),对诊断有一定提示作用。实践诊断过程中,分子病理技术不常使用。
3. 对于疑似“杂交瘤”的病例,可以考虑增加FLCN基因突变检测。实践诊断过程中最优选的分子检测手段是高通量测序(肿瘤相关基因panel)。需要注意的是,杂交瘤只是有部分病例与Birt-Hogg-Dubé综合征相关,因此FLCN基因突变并不是确诊“杂交瘤”的必须依据,亦不是具有FLCN基因突变的肿瘤都为杂交瘤。
:arrow_forward: 透明细胞乳头状肾细胞癌(ccpRCC)
ccpRCC是2006年新提出的一种独立的分类,约占肾癌的4%。是一种由形态温和透亮细胞组成的惰性肿瘤,瘤细胞主要排列成管状、乳头状结构,往往可见肿瘤细胞核远离细胞基底部而朝向腔面分布现象。2006年以前,ccpRCC最常被诊断为ccRCC,而随着肿瘤分类的完善,发现ccpRCC具有独特的形态学特点和免疫表型,它阳性表达CK7、高分子质量细胞角蛋白和GATA3,CAⅨ呈特征性的“杯状”着色模式,不表达P504s,不表达或局灶弱阳性表达CD10,因此,不难将其与ccRCC和pRCC区分开来。此外,ccpRCC几乎不存在VHL基因改变或3p缺失,其基因组相对稳定,目前没有发现特征性的遗传改变或拷贝数变化的模式[2]。
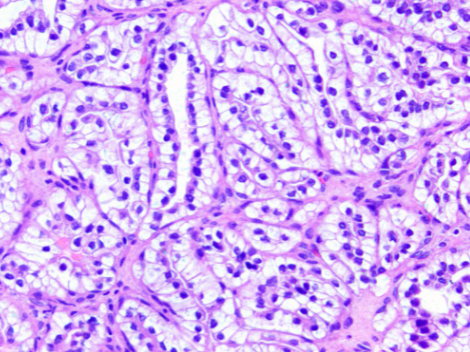
ccpRCC是一种惰性肿瘤,其ICD-O编码为1,代表其生物学行为等同于交界性肿瘤,几乎不复发转移,因此明确诊断ccpRCC具有非常重要的临床意义[3]。同时,诊断ccpRCC需要慎重,当遇到疑似肿瘤,但其免疫组织化学结果不“完美”符合,例如P504S或CD10明显阳性,或CK7着色不够弥漫,最好将其诊断为ccRCC。
专家组建议要点:
1.ccpRCC通常可以根据典型的组织学特征辅以免疫表型明确诊断;其免疫组织化学表达经典模式为:CAⅨ、CK7、高分子质量细胞角蛋白和GATA3阳性,P504s和CD10阴性。
2.对于形态学特征介于ccRCC和ccpRCC之间的病例,必须加做免疫组织化学辅助诊断,免疫组织化学结果不能确切的贴合ccpRCC则诊断为ccRCC。
3.对于疑难病例可增加分子检测方法,如发现VHL基因改变或3p缺失可除外ccpRCC的诊断。
:arrow_forward:MIT家族易位性肾细胞癌(MIT family translocation-associated RCC)
MIT家族易位性肾细胞癌涉及MIT转录因子家族成员TFE3、TFEB及新近证实的MITF基因易位,包括Xp11.2易位/TFE3基因融合相关性肾细胞癌(Xp11 RCC)、TFEB基因易位性肾细胞癌(TFEB RCC)、MITF基因易位性肾细胞癌(MITF RCC)三种类型。
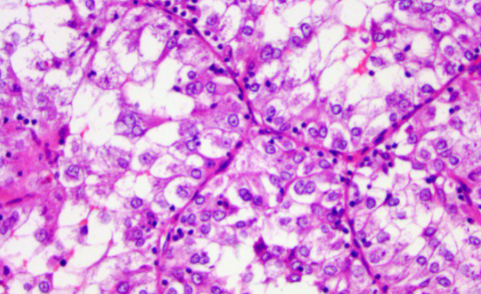
Xp11 RCC是其中最常见的一种亚型,以X染色体短臂同其他染色体易位并产生TFE3基因融合为特征。目前已报道多种不同的TFE3融合基因伴侣,包括ASPSCR1、PRCC、SFPQ、NONO、CLTC、PARP14、LUC7L3、KHSRP、DVL2、FUBP1、MATR3、MED15、NEAT1、RBM10、KAT6A、GRIPAP1、EWSR1等[10]。
不同的融合基因亚型会有不同的形态学表现,据此可以在一定程度上帮助病理医师识别可能的融合基因伴侣。ASPSCR1-TFE3 RCC通常具有宽大的乳头状结构,细胞胞质宽大、丰富,同时伴有多量沙砾体。PRCC-TFE3 RCC则更多地表现出巢状或实性片状结构,无明显乳头状结构,细胞胞质稀少,核级别较低,伴有少量沙砾体。
SFPQ-TFE3 RCC具有特征性的核下空泡的形态,类似于ccpRCC,也可形成假菊形团样结构或小细胞的聚集,类似于TFEB RCC的形态。NONO-TFE3 RCC通常由成片的上皮样细胞和腺管状、乳头状结构混合组成,这些腺管状或乳头状结构内衬中等大小立方至高柱状细胞,胞质透明或絮状嗜酸性,细胞核圆形,形态均匀一致,并且整齐地排列在腔面,远离基底膜,出现核下空泡的现象,类似分泌期子宫内膜样腺体,也与ccpRCC相似,该类型中核下空泡比SFPQ-TFE3 RCC更为常见。
RBM10-TFE3 RCC较为罕见,目前报道的病例中大多数会出现双向结构,即上皮样细胞构成的腺管状和(或)乳头状结构与小细胞区域形成的假菊形团样结构混合存在,另可见胞质空泡化、核沟和沙砾体等特点。MED15-TFE3 RCC是近来新认识的亚型,其镜下形态极具特征性,通常呈现广泛的囊性结构,与低度恶性潜能的多房性囊性肾肿瘤极为相似,容易误诊。虽然在Xp11 RCC中不同的融合基因表现出各自独特的形态学特点,但不同基因亚型之间依然可能存在形态学上的交叉。其余融合基因亚型均为个案报道,特定的形态学特征尚未得到证实。
TFEB RCC是以6号染色体短臂同其他染色体发生易位,致使位于6p21的转录因子TFEB形成融合基因为特征。典型结构为双向形态,癌组织成巢状排列,由大小两种上皮细胞组成,其中形态较小的上皮细胞巢状排列并围绕着玻璃样变的基底膜样物质形成菊形团样结构。目前2016版WHO仅纳入了MALATA1-TFEB一种基因易位形式,并以此命名为t(6;11)(p21;q12)/MALATA1-TFEB基因融合相关性肾癌。
实际文献报道中也发现了多种TFEB基因易位形式,除最常见的MALATA1-TFEB外,还包括COL21A1-TFEB、CADM2-TFEB、KHDRBS2-TFEB、ACTB-TFEB、EWSR1-TFEB、CLTC-TFEB、PPP1R10-TFEB。未来在新一版的WHO中有可能不再将TFEB易位性肾癌单纯命名为t(6;11)相关性肾癌,而是类似于TFE3易位性肾癌来命名[11]。
长期以来MIT家族易位性肾细胞癌中只包括Xp11 RCC和TFEB RCC两种类型,而MITF RCC的发现填补了MIT家族易位性肾细胞癌中MITF易位类型的空白。目前仅有2例报道,十分罕见,分别为PRCC-MITF和CLTC-MITF基因易位形式[12]。
当肿瘤中出现MIT家族易位性肾癌的形态学特点,免疫组织化学表达PAX8,但不表达TFE3/TFEB,同时TFE3、TFEB分离探针FISH检测也为阴性时,应该要考虑到MITF易位性肾细胞癌的可能性,可采用MITF分离FISH和更高敏感度的RNA-seq来确认MITF基因重排。另外需要注意的是,最新的研究表明有一种类型肾癌具有TFEB RCC样形态,呈双向形态特征,有菊形团样结构伴多量沙砾体,但进一步的基因检测没有发现任何MIT基因家族易位的证据,却发现了NF2基因致病性突变,具有这些特征的肾细胞癌是否构成一类独立的肾癌亚型还有待进一步的临床病理特点、生物学行为及分子遗传学研究。
TFE3/TFEB抗体被认为是Xp11 RCC/TFEB RCC特征性的分子标志物,此外TFEB RCC和一部分Xp11 RCC病例可表达色素相关标记Cathepsin-K、Melan A和HMB45。TFE3/TFEB、Cathepsin-K、Melan A或HMB45联合应用可提高诊断Xp11 RCC/TFEB RCC的敏感性,也有助于判断基因亚型。FISH技术对于检测大多数TFE3/TFEB基因易位快速、可靠且成功率高,但是对于同一染色体内的基因易位,如NONO-TFE3、RBM10-TFE3、GRIPAP1-TFE3及新近发现的PPP1R10-TFEB基因易位形式,使用FISH方法进行检测时,红绿信号分开距离小或几乎不分开,有时会判读为假阴性结果。此时RNA-seq等更为精准的分子诊断方法更有优势。
专家组建议要点:
1.对MIT家族易位肾癌的诊断有提示意义的特征包括:年轻患者、乳头状形态为主的混合性形态、菊形团样结构、细胞边界不清、胞质呈絮状、间质可见沙砾体。
2.TFE3/TFEB、Cathepsin-K、Melan A或HMB45联合应用可提高诊断Xp11 RCC/TFEB RCC的敏感性。
3.使用TFE3/TFEB分离探针进行FISH检测可以对大多数Xp11 RCC/TFEB RCC精确且便捷诊断,但是对于发生在同一染色体内的基因易位(如NONO-TFE3、RBM10-TFE3、GRIPAP1-TFE3及PPP1R10-TFEB基因亚型),红绿信号分开距离小或几乎不分开,有时会判读为假阴性结果。可能需要应用RNA-seq等更为精准的分子诊断方法。
4.对于具有MIT家族易位性肾癌的形态学特点,免疫组织化学表达PAX8,但不表达TFE3/TFEB,同时TFE3/TFEB分离探针FISH检测也为阴性时,要考虑到MITF RCC或者NF2突变相关RCC的可能性,可采用MITF分离FISH和更高灵敏度的RNA-seq来辅助诊断。
:arrow_forward: 肾髓质癌
肾髓质癌是一类高度侵袭性的恶性肿瘤,主要见于镰状红细胞血症或其他罕见血红蛋白疾病的年轻患者,文献报道多数发生于非洲裔人群。镜下此类肿瘤呈不规则腺管状、乳头状结构浸润性生长,常伴有坏死及炎症背景。其分子特征是位于22号染色体上的染色质重塑SMARCB1(INI1)基因失活,其发生机制包括半合子缺失、基因平衡易位、纯合子缺失或致病性胚系突变[3]。
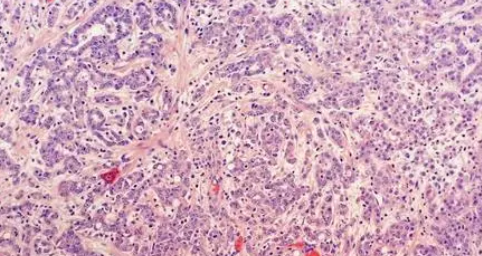
因此,SMARCB1(INI1)蛋白表达缺陷是诊断RMC重要的分子免疫表型。参与干细胞表型的转录因子OCT3/4在RMC中也会阳性表达,而在集合管癌和FH缺陷型肾癌中不表达,OCT3/4阳性可能对于诊断肾髓质癌起辅助作用。
值得注意的是,有一类罕见肿瘤具有肾髓质癌样形态、SMARCB1(INI1)蛋白表达缺失以及高度侵袭性的生物学行为,但患者没有镰状红细胞血症或其他血红蛋白疾病,目前将这类肿瘤称为伴有肾髓质癌表型的未能分类肾细胞癌,确定这类肿瘤的正确分类还需要更多的研究[14]。
专家组建议要点:
1.当肿瘤出现小管状或乳头状结构浸润性生长模式、INI1蛋白表达缺失时,确定镰状红细胞血症或其他血红蛋白疾病病史、仔细寻找肿瘤间质及血管内弥漫的镰状红细胞对于诊断肾髓质癌至关重要。实践诊断过程中,INI1缺失最便捷的检测手段是免疫组织化学标记,但仅凭INI1蛋白缺失不能诊断肾髓质癌,部分高级别肾细胞癌/集合管癌亦存在INI1蛋白缺失。
2.如果肿瘤形态、免疫表型及分子改变都符合RMC的特征,但患者没有镰状红细胞血症或其他血红蛋白疾病,目前称之为伴有肾髓质癌表型的未能分类肾细胞癌。在中国人群中诊断肾髓质癌需格外谨慎。
:arrow_forward: 集合管癌
集合管癌也是一类罕见的好发于肾髓质区的高度恶性的肾癌亚型,其形态上与肾髓质癌及FH缺陷型肾癌均有不同程度的交叉重叠,都可表现出浸润性生长模式、腺管状/巢状/条索状结构等非特异性形态。上述组织学特征结合镰状红细胞血症病史及SMARCB1(INI1)蛋白表达缺失可诊断RMC,而FH和2SC免疫组织化学检测有助于FH缺陷型肾癌的诊断。除此以外,集合管癌的诊断还需仔细排除尿路上皮癌和转移性癌的可能性。近来对集合管癌的分子特征研究中最为常见的是NF2、SETD2、CDKN2A基因突变。文献报道中还有一部分病例伴有SMARCB1(INI1)基因失活或FH基因突变,这些实际应分别归入伴有肾髓质癌表型的未能分类肾细胞癌和FH缺陷型肾癌中[3]。
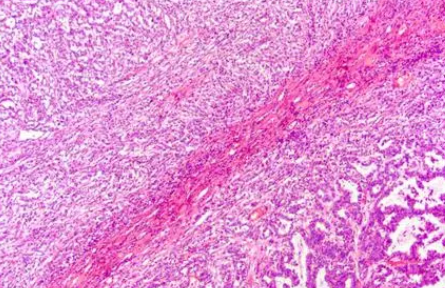
专家组建议要点:
在诊断集合管癌之前,需要排除尿路上皮癌、转移性癌、RMC以及FH缺陷型肾癌。
:arrow_forward: 黏液样小管状和梭形细胞癌(MTSCC)
MTSCC镜下形态温和,由紧密排列的小管状结构组成,与梭形细胞移行,间质中有多少不等的黏液。新近多个研究表明,MTSCC与Hippo信号通路失活有关,其中抑癌基因PTPN14和NF2突变最为常见。经典形态的MTSCC还涉及多个染色体改变,包括1、4、6、8、9、13、14、15、22号和X染色体的丢失或部分丢失,并无7号和17号染色体获得现象,说明在基因水平上MTSCC是不同于pRCC的独特类型[2]。此外,Wang等[15]结合多个公共数据库RNA-seq数据寻找MTSCC特异性分子标志物,随后利用RNA原位杂交方法检测VSTM2A表达情况,结果表明VSTM2A过表达是诊断及鉴别诊断MTSCC有价值的标志物。
专家组建议要点:
MTSCC组织学形态不典型时,可行基因检测辅助诊断及鉴别诊断。MTSCC常见1、4、6、8、9、13、14、15、22号和X染色体的丢失或部分丢失,而无7、17号染色体获得现象。实践诊断过程中以形态学诊断为主,当与PRCC伴有梭形细胞成分鉴别时,可用FISH检测7号、17号染色体三倍体,阳性结果更支持PRCC的诊断。
:arrow_forward: 获得性囊性肾病相关性肾癌(ACKD RCC)
ACKD RCC是近几年逐渐认识的一类独特的肾细胞癌类型,是终末期肾病和获得性囊性肾病中继发性肾细胞癌中最常见的亚型。肿瘤组织学构型多样,特征性的表现为裂隙状的微囊性结构以及肿瘤内大量的草酸钙结晶沉积。ACKD RCC的基因组特征更接近于pRCC和ccpRCC,常涉及多个染色体改变,包括3、6、7、16、17和Y染色体等,其中3号染色体获得最为常见[3]。
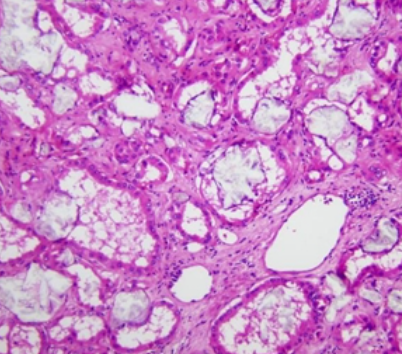
专家组建议要点:
常规工作中,临床病史如透析史,以及特征性的草酸盐结晶可帮助识别此类肿瘤。
:arrow_forward: 管状囊性肾细胞癌(TCRCC)
TCRCC是一种由管状和囊性结构构成的肾细胞癌,有时会混有pRCC的形态学特征。分子特征方面常伴有7和17号染色体获得以及Y染色体缺失,提示其与pRCC的密切关系,认为TCRCC是pRCC的一种变异型。但也有一些研究发现形态学上完全为管状囊性癌结构的病例缺乏7和17号染色体获得和Y染色体缺失,而具有9号染色体缺失现象。因此,TCRCC与pRCC之间是否存在紧密关系尚存在争议。罕见的情况下,可见TCRCC样形态的肿瘤伴有局灶的肉瘤样分化或出现高级别浸润性癌特征,这一类肿瘤诊断为TCRCC需谨慎,目前看来多数可能是HLRCC-RCC或FH缺陷型肾癌[2]。
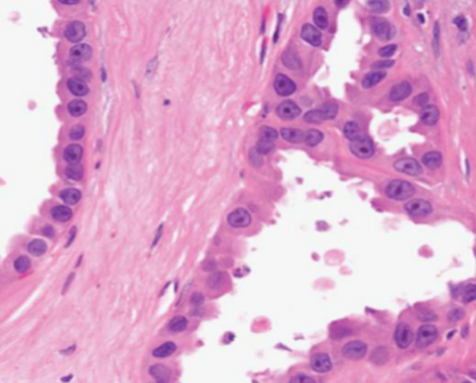
专家组建议要点:
当肿瘤中出现类似TCRCC的组织学特点并且具有其他异质性形态时,应考虑到HLRCC或FH缺陷型肾癌的可能性。
:arrow_forward: “琥珀酸脱氢酶缺陷型肾癌(SDH缺陷型肾细胞癌)”
琥珀酸脱氢酶(SDH)是由4种亚单位组成的线粒体酶复合物,包括SDHA、SDHB、SDHC和SDHD。SDH亚单位编码的基因缺陷与多种疾病有关,如嗜铬细胞瘤、副神经节瘤、胃肠道间质瘤、SDH缺陷型肾细胞癌。
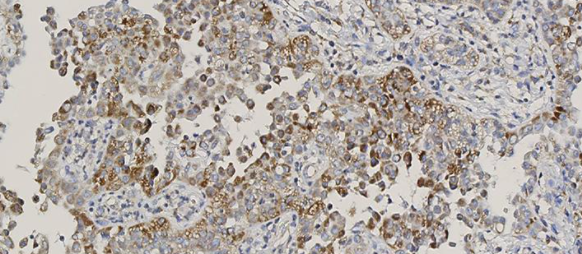
SDH基因缺陷患者几乎均有SDH胚系突变,其中任何一种基因突变,SDHB免疫组织化学均为缺失表达,这也是诊断SDH缺陷型肾癌的必要条件。在判读SDHB免疫组织化学阴性结果时,一定需要阳性内对照的存在。如果肿瘤细胞呈弥漫但微弱表达,而非肿瘤细胞(如周围正常组织或血管内皮细胞)出现强颗粒状胞质染色时,应将SDHB免疫组织化学结果判读为阴性。当出现SDHA基因双打击缺陷时,SDHA免疫组织化学也会缺失表达。SDHA基因的胚系突变也会存在于健康人群中(某些研究中可高达0.3%),其外显率比较低(目前估计为1.7%)。因此,SDHA突变必须要放在临床背景下解释才具有其临床意义。
SDH缺陷型肾细胞癌是2016版WHO肾脏肿瘤分类中新纳入的一种肾癌亚型。镜下肿瘤边界清楚,但周边常可见内陷的肾小管,通常会有囊性变。肿瘤细胞胞质丰富,呈絮状嗜酸性,具有特征性的胞质内半透明絮状包涵体。此外类似于ccRCC、pRCC或未分类肾细胞癌的形态也有报道。该类型肾癌中约2/3为低级别病例,预后较好,很少发生转移;少部分病例出现的凝固性坏死或肉瘤样分化被认为是预后不良的高风险因素,转移率可高达70%。迄今为止报道的病例大多数只涉及一种SDH基因缺陷,通常为SDHB或者SDHC基因。SDHA缺陷相关性肾癌十分罕见,目前报道的病例通常表现出不同的形态学特征如pRCC样、CDC样形态等,并且通常是在进行基因检测之后才被发现,此时SDHA免疫组织化学检测可用于区分无意义突变还是致病性突变,致病性突变会导致SDHA蛋白失表达,无意义突变则不会[2, 3]。
专家组建议要点:
1.在判读SDHB免疫组织化学阴性结果时,要注意肿瘤内部是否存在阳性内对照,另需识别弥漫微弱染色的病例,在内对照强阳性的情况下,也应判断为阴性结果。
2.特征性的胞质内半透明絮状包涵体是识别SDH缺陷型肾细胞癌的重要诊断依据,但目前也有越来越多变异的形态被报道,当出现其他不同寻常的形态时也应考虑到SDH缺陷型肾细胞癌的可能性。
3.SDH缺陷型肾细胞癌通常发生于SDH胚系突变(SDHB最常见)的患者,因此在诊断时应仔细询问家族病史。实践诊断过程中最优选的分子检测手段是高通量测序(肿瘤相关基因panel检测)。
:arrow_forward: “遗传性平滑肌瘤病和肾细胞癌综合征相关性肾细胞癌(HLRCC-RCC)”
HLRCC综合征(hereditary leiomyomatosis and renal cell carcinoma syndrome)是由延胡索酸水合酶(fumarate hydratase,FH)基因胚系突变导致的一种常染色体显性遗传性疾病,表现为皮肤或子宫多发的平滑肌瘤、早发性肾细胞癌,罕见情况下还会发生嗜铬细胞瘤。与SDH基因缺陷相似,FH基因缺陷也可根据免疫组织化学检测FH蛋白缺失表达来判断。但是与SDHB抗体不同的是,FH蛋白的缺失表达对于提示FH基因缺陷并不完全敏感,目前估计仅80%~90%的FH缺陷性肿瘤会缺失表达FH蛋白。2SC(一种改组的半胱氨酸)是由FH失活致延胡索酸异常富集而形成的产物,其过表达也可提示FH基因缺陷,有望成为检测FH基因缺陷更为敏感的标志物[3]。罕见情况下,FH缺陷型肾癌的FH免疫组织化学表达未缺失,而2SC存在过表达,因此,FH/2SC联合检测将提高诊断的准确性[16]。
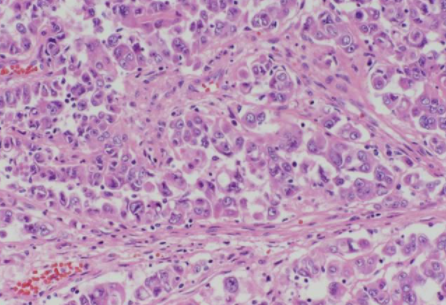
HLRCC-RCC最初认识的形态是2型pRCC样形态伴有明显的包涵体样核仁。随后的报道发现HLRCC-RCC常具有多种结构混合存在的特点,除了经典的2型pRCC样形态,还会有实性、筛状、管状囊性及肉瘤样等形态混合存在。需要注意的是,虽然HLRCC-RCC常呈现高级别肿瘤的形态学特征,但低级别嗜酸性形态也有报道,形态类似于SDH缺陷型肾癌,需要加以鉴别[17]。
此外,考虑到FH免疫组织化学敏感性不足以及2SC抗体相对缺乏,当形态学特征考虑FH缺陷型肾细胞癌时,即使FH抗体阳性表达,也应该进行基因检测。特征性的临床病史和特异性FH基因突变有助于确诊。
专家组建议要点:
1.2型pRCC样形态伴有明显的嗜酸性大核仁可有助于病理医师识别FH缺陷型肾细胞癌,并进一步行免疫组织化学或分子检测。
2.当肿瘤中出现明显的异质性形态(乳头状、管状囊性、浸润性生长或者混合性结构,伴或不伴有明显的核仁),也要考虑到FH缺陷型肾细胞癌的可能性,并进一步行免疫组织化学或分子检测。
3.10%~20% FH缺陷型肿瘤仍然阳性表达FH蛋白,因此对于形态学怀疑FH缺陷型的病例,即便FH阳性或模棱两可的表达模式都不能排除FH基因突变的可能,应联合FH/2SC免疫组织化学检测,分子检测更为可靠。实践诊断过程中最优选的分子检测手段是高通量测序(肿瘤相关基因panel)。
4.尽管FH也会发生单纯的体细胞突变(特别是老年妇女的子宫平滑肌瘤中),但迄今为止报道的大多数FH缺陷型肾细胞癌都具有FH胚系突变,因此在诊断时要注意询问家族病史并建议遗传咨询。

新出现的肾脏肿瘤类型
:arrow_forward: 嗜酸性实性与囊性肾细胞癌(eosinophilic solid and cystic RCC,ESC RCC)
2016年Trpkov等[18, 19]首次报道了一类囊实性结构的嗜酸性肾肿瘤,形态学高度类似结节性硬化综合征相关性肾细胞癌中的一部分,但患者并无结节性硬化症,将其命名为ESC RCC。在最初的报道中,该肿瘤全部发生于女性患者。形态学上,该肿瘤多呈囊性及实性生长结构,肿瘤细胞胞质丰富嗜酸,含特征性的点彩状胞质和粗大颗粒,以及胞质内致密的“利什曼病样”小球(“Leishmaniasis-like”globules)。
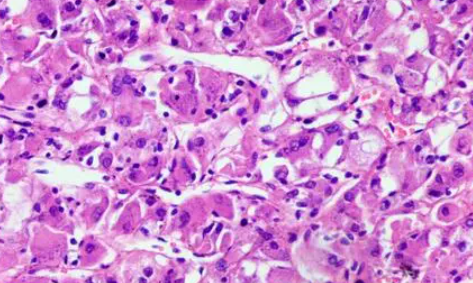
核圆至卵圆形,核仁明显。免疫组织化学提示该肿瘤表达CK20(或局灶阳性),CK7多数为阴性。后续研究发现无结节性硬化症患者的ESC RCC普遍存在TSC1/TSC2基因体细胞突变,应属于TSC1/TSC2基因突变相关性肾细胞癌的一种散发形式[20]。
由于ESC RCC具有独特的形态特征、免疫表型和分子改变,因此有望被WHO分类列为一种独立的肾癌类型。
专家组建议要点:
1.ESC RCC具有独特而稳定的形态特征、免疫表型和分子改变,高度支持将其列为一种独立的肾癌类型。
2.实践诊断过程中主要依赖典型的形态特征和免疫表型(CK20+,CK7-)作出诊断,如需分子病理辅助诊断,最优选的分子检测手段是高通量测序(肿瘤相关基因panel检测)。
:arrow_forward: 伴有TSC/MTOR基因突变的肾细胞癌
除ESC RCC外,近期还有另外2种具有特征性形态学结构的肿瘤被描述和报道与TSC/MTOR基因突变相关。一种是“富于平滑肌间质的肾细胞癌”形态,透明的肿瘤细胞排列成腺状、乳头状结构,间质富于平滑肌,具有此形态特征的肿瘤中,一部分存在TSC1、TSC2或MTOR基因突变;另一种形态接近嫌色细胞性肾细胞癌,肿瘤细胞胞质嗜酸性,细胞核与嫌色细胞癌中的不同,不皱缩,且核仁明显,胞质常可见空泡状结构;由于其显著的核仁,该肿瘤最先被命名为“high-grade oncocytic tumor,HOT”,实际上它是一种惰性肿瘤。肿瘤组织存在TSC2或MTOR基因突变[21, 22]。
上述两种具有TSC/MTOR基因突变的肿瘤,与ESC RCC一样,仅一部分患者存在结节性硬化综合征,另一部分患者为散发性肿瘤;无论遗传性综合征还是散发性肿瘤,均是由于TSC/MTOR基因改变,激活MTOR信号通路所致。
专家组建议要点:
1.新近报道的其他形态的具有TSC/MTOR基因突变的肿瘤,有望在未来的分类中被单独列出。
2.实践诊断过程中最优选的分子检测手段是高通量测序(肿瘤相关基因panel检测)。
:arrow_forward: TCEB1突变的肾细胞癌
上文所述类似“富于平滑肌间质的肾细胞癌”形态的肿瘤(透明的肿瘤细胞排列成腺状、乳头状结构,间质富于平滑肌)中,一部分存在TSC/MTOR基因突变,而亦有一部分存在TCEB1基因突变,常伴有8号染色体缺失(单倍体)。TCEB1基因编码的Elongin C蛋白绑定VHL基因,和其他一些蛋白共同构成VHL复合物调控HIF1通路。TCEB1基因突变理论上应该和VHL突变有类似的效果。目前尚无定论是否应把TCEB1突变的肿瘤从ccRCC中分离出来,因为TCEB1突变的肿瘤形态学上同样表现为透明细胞,免疫表型表达CAⅨ,仅CK7阳性这一表型与经典ccRCC稍有区别。据观察,绝大多数TCEB1突变病例生物学行为惰性,文献有个别转移病例报道[23]。
专家组建议要点:目前尚未有充分证据支持TCEB1基因突变的肾癌是一种独立类型。
:arrow_forward: TFEB/6p21/VEGFA扩增的肾细胞癌
TFEB/6p21/VEGFA扩增的肾细胞癌是一种新近报道的高度侵袭性肿瘤,形态学多样,大部分类似pRCC,亦有ccRCC或chRCC样形态[24]。免疫组织化学TFEB/6p21/VEGFA扩增的肾细胞癌与TFEB基因易位性肾癌类似,常表达色素分化相关标记(Melan A、HMB45和cathepsin K)。用TFEB基因分离探针检测,会发现肿瘤存在TFEB基因所在区域(6p21区域)的多倍体扩增,一般不伴有TFEB基因重排。研究认为,该肿瘤侵袭性的行为可能是由于同在6p21的其他重要基因,如VEGFA和CCND3扩增导致的[2]。
专家组建议要点:
1.有证据提示TFEB/6p21/VEGFA扩增的肾细胞癌是一类高度侵袭性的独立肾癌类型。
2. 实践诊断过程中最优选的分子检测手段是荧光原位杂交。
:arrow_forward: 间变性淋巴瘤激酶(ALK)易位性肾细胞癌
ALK是一种酪氨酸激酶受体蛋白,其所对应的ALK基因易位被报道与多种肿瘤密切相关,包括:间变性大细胞淋巴瘤、炎性肌纤维母细胞瘤、ALK易位性肺癌等。近年来在肾细胞癌中也发现ALK基因易位,病例数逐渐增加。ALK易位性肾癌在形态上多为乳头状或筛状结构,常伴有黏液产生,有时表现为弥漫性肉瘤样呈未分类肾细胞癌的形态[25]。ALK易位性肾癌中也会有多种基因易位形式:VCL-ALK、TPM3-ALK、EML4-ALK、STRN-ALK、HOOK1-ALK、CLIPI-LAK、KIF5B-ALK[2]。
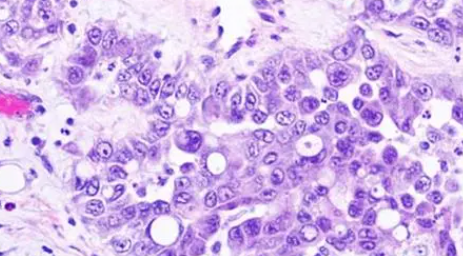
VCL-ALK易位形式的肾细胞癌多与镰状红细胞血症有关,形态学上常具有明显的胞质内空泡。也有个别报道VCL-ALK RCC呈现RMC或CDC样形态,但没有明显的胞质内空泡,且不伴有镰状红细胞血症。最近报道的ALK易位性肾癌还出现了类似于后肾腺瘤或黏液小管状梭形细胞癌的形态。值得注意的是,ALK易位性肿瘤对于二代ALK抑制剂阿莱替尼的治疗敏感,获得了一定的临床疗效,这也就意味着ALK易位性肾癌可从ALK基因靶向治疗中获益。弥漫强阳性表达ALK蛋白和分子检测ALK基因重排有助于确诊。
专家组建议要点:
1.鉴于ALK易位性肾癌具有潜在的靶向治疗策略,目前该类型被列为一类独立的肾细胞癌亚型。
2. 实践诊断过程中最优选的分子检测方法是荧光原位杂交。

总结
分子病理学技术的进展极大地拓宽了我们对肾细胞癌的认识,并不断重塑和阐明新的肿瘤类型。肾细胞癌中存在的分子遗传学异常多数可以用相对简单的诊断方法来替代应用,如特征性的组织学形态和免疫组织化学,这也在一定程度上减少了在诊断实践中进行广泛的分子检测的需求。肿瘤分子病理学的不断发展无疑会对肾细胞癌的分类、判断预后和提供治疗选择产生重大影响,促使病理诊断工作者紧跟时代的步伐,不断更新自己的知识和理念,为实现更精准的个体化治疗作出贡献。
-----------END--------------
参考文献(滑动查看)
1HsiehJJ, LeV, CaoD, et al. Genomic classifications of renal cell carcinoma: a critical step towards the future application of personalized kidney cancer care with pan-omics precision[J].J Pathol, 2018, 244(5):525-537. DOI: 10.1002/path.5022.
2WilliamsonSR, GillAJ, ArganiP, et al. Report from the International Society of Urological Pathology (ISUP) Consultation Conference on molecular pathology of urogenital cancers: III: molecular pathology of kidney cancer[J]. Am J Surg Pathol, 2020, 44(7):e47-e65. DOI: 10.1097/PAS.0000000000001476.
3MochH, HumphreyPA, UlbrightTM, et al. WHO classification of tumours of the urinary system and male genital organs [M].4th ed.Lyon:IARC Press, 2016.
4GossageL, MurtazaM, SlatterAF, et al. Clinical and pathological impact of VHL, PBRM1, BAP1, SETD2, KDM6A, and JARID1c in clear cell renal cell carcinoma[J]. Genes Chromosomes Cancer, 2014, 53(1):38-51. DOI: 10.1002/gcc.22116.
5PivaF, SantoniM, MatranaMR, et al. BAP1, PBRM1 and SETD2 in clear-cell renal cell carcinoma: molecular diagnostics and possible targets for personalized therapies[J]. Expert Rev Mol Diagn, 2015, 15(9):1201-1210. DOI: 10.1586/14737159.2015.1068122.
6LeeBH. Commentary on: "Comprehensive molecular characterization of papillary renal-cell carcinoma." Cancer Genome Atlas Research Network.: N Engl J Med. 2016 Jan 14; 374(2):135-45[J]. Urol Oncol, 2017, 35(9):578-579. DOI: 10.1016/j.urolonc.2017.07.022.
7SaleebRM, BrimoF, FaragM, et al. Toward biological subtyping of papillary renal cell carcinoma with clinical implications through histologic, immunohistochemical, and molecular analysis[J]. Am J Surg Pathol, 2017, 41(12):1618-1629. DOI: 10.1097/PAS.0000000000000962.
8Al-ObaidyKI, EbleJN, ChengL, et al. Papillary renal neoplasm with reverse polarity:a morphologic, immunohistochemical, and molecular study[J]. Am J Surg Pathol, 2019, 43(8):1099-1111. DOI: 10.1097/PAS.0000000000001288.
9KimSS, ChoYM, KimGH, et al. Recurrent KRAS mutations identified in papillary renal neoplasm with reverse polarity-a comparative study with papillary renal cell carcinoma[J]. Mod Pathol, 2020, 33(4):690-699. DOI: 10.1038/s41379-019-0420-8.
10WangXT, XiaQY, YeSB, et al. RNA sequencing of Xp11 translocation-associated cancers reveals novel gene fusions and distinctive clinicopathologic correlations[J]. Mod Pathol, 2018, 31(9):1346-1360. DOI: 10.1038/s41379-018-0051-5.
11XiaQY, WangXT, FangR, et al. Clinicopathologic and molecular analysis of the TFEB fusion variant reveals new members of TFEB translocation renal cell carcinomas (RCCs): expanding the genomic spectrum[J]. Am J Surg Pathol, 2020, 44(4):477-489. DOI: 10.1097/PAS.0000000000001408.
12XiaQY, WangXT, YeSB, et al. Novel gene fusion of PRCC-MITF defines a new member of MiT family translocation renal cell carcinoma: clinicopathological analysis and detection of the gene fusion by RNA sequencing and FISH[J]. Histopathology, 2018, 72(5):786-794. DOI: 10.1111/his.13439.
13ArganiP, ReuterVE, EbleJN, et al. Biphasic hyalinizing psammomatous renal cell carcinoma (BHP RCC): a distinctive neoplasm associated with somatic NF2 mutations[J]. Am J Surg Pathol, 2020, 44(7):901-916. DOI: 10.1097/PAS.0000000000001467.
14SirohiD, SmithSC, OheC, et al. Renal cell carcinoma, unclassified with medullary phenotype: poorly differentiated adenocarcinomas overlapping with renal medullary carcinoma[J]. Hum Pathol, 2017, 67:134-145. DOI: 10.1016/j.humpath.2017.07.006.
15WangL, ZhangY, ChenYB, et al. VSTM2A overexpression is a sensitive and specific biomarker for mucinous tubular and spindle cell carcinoma (MTSCC) of the Kidney[J]. Am J Surg Pathol, 2018, 42(12):1571-1584. DOI: 10.1097/PAS.0000000000001150.
16GuptaS, SwansonAA, ChenYB, et al. Incidence of succinate dehydrogenase and fumarate hydratase- deficient renal cell carcinoma based on immunohistochemical screening with SDHA/SDHB and FH/2SC[J]. Hum Pathol, 2019, 91:114-122. DOI: 10.1016/j.humpath.2019.07.004.
17LauHD, ChanE, FanAC, et al. A clinicopathologic and molecular analysis of fumarate hydratase-deficient renal cell carcinoma in 32 patients[J]. Am J Surg Pathol, 2020, 44(1):98-110. DOI: 10.1097/PAS.0000000000001372.
18TrpkovK, HesO, BonertM, et al. Eosinophilic, solid, and cystic renal cell carcinoma: clinicopathologic study of 16 unique, sporadic neoplasms occurring in women[J]. Am J Surg Pathol, 2016, 40(1):60-71. DOI: 10.1097/PAS.0000000000000508.
19TrpkovK, Abou-OufH, HesO, et al. Eosinophilic solid and cystic renal cell carcinoma (ESC RCC): further morphologic and molecular characterization of ESC RCC as a distinct entity[J]. Am J Surg Pathol, 2017, 41(10):1299-1308. DOI: 10.1097/PAS.0000000000000838.
20MehraR, VatsP, CaoX, et al. Somatic Bi-allelic loss of TSC genes in eosinophilic solid and cystic renal cell carcinoma[J]. Eur Urol, 2018, 74(4):483-486. DOI: 10.1016/j.eururo.2018.06.007.
21HeH, TrpkovK, MartinekP, et al. "High-grade oncocytic renal tumor": morphologic, immunohistochemical, and molecular genetic study of 14 cases[J]. Virchows Arch, 2018, 473(6):725-738. DOI: 10.1007/s00428-018-2456-4.
22ChenYB, MirsadraeiL, JayakumaranG, et al. Somatic mutations of TSC2 or MTOR characterize a morphologically distinct subset of sporadic renal cell carcinoma with eosinophilic and vacuolated cytoplasm[J]. Am J Surg Pathol, 2019, 43(1):121-131. DOI: 10.1097/PAS.0000000000001170.
23HakimiAA, TickooSK, JacobsenA, et al. TCEB1-mutated renal cell carcinoma: a distinct genomic and morphological subtype[J]. Mod Pathol, 2015, 28(6):845-853. DOI: 10.1038/modpathol.2015.6.
24ArganiP, ReuterVE, ZhangL, et al. TFEB-amplified renal cell carcinomas: an aggressive molecular subset demonstrating variable melanocytic marker expression and morphologic heterogeneity[J]. Am J Surg Pathol, 2016, 40(11):1484-1495. DOI: 10.1097/PAS.0000000000000720.
25HodgeJC, PearceKE, SukovWR.Distinct ALK-rearranged and VCL-negative papillary renal cell carcinoma variant in two adults without sickle cell trait[J]. Mod Pathol, 2013, 26(4):604-605. DOI: 10.1038/modpathol.2012.144.
声明:本文来源于肿瘤科空间。













