
克隆性造血(Clonal hematopoiesis, CH)是一种常见的与衰老相关的生物学状态,易导致恶性血液病或心血管疾病。在血液中,某些突变会使得造血干细胞(HSC)获得自我增殖的能力,其过度增殖就会引发克隆性造血。CH没有明显的临床症状,但随着年龄的增长,这种疾病变得无处不在,是发展为血癌和其他与年龄相关疾病的风险因素。事实上,虽然CH是由其与体细胞突变的关联来定义的,但它的发展受非突变因素和可遗传基因组的共同影响。
近日,由布里斯托大学、剑桥大学、桑格研究所、西班牙阿斯图里亚斯健康研究所和阿斯利康公司组成的联合研究团队,对200,453名个体进行了全基因组分析,为认知CH提供了新见解。该研究揭示了与CH相关的多个新的胚系基因位点,包括与特定CH亚型相互作用的基因位点,同时揭示了跨器官系统中CH与多种病理状态间的因果关系,并为吸烟和端粒长度与CH风险之间的因果关系提供了证据。该研究成果已在线发表于Nature Genetics期刊上,文章题为“Genome-wide analyses of 200,453 individuals yield new insights into the causes and consequences of clonal hematopoiesis”。

文章已发表在Nature Genetics上
为识别存在CH的个体,研究人员对来自英国生物库(UKB)的200,453名不同血统参与者的血液全外显子组测序(WES)数据进行分析,参与者年龄在38-72岁之间。同时,研究人员还根据数据调用了43个CH基因中的体细胞突变,根据定义的CH驱动变异列表对其进行过滤,在10.924名个体中发现11,697个突变,显示出与此前报告一致的模式(图1a)。此外,数据显示,CH患病率上升在不同驱动基因之间存在差异(图1b),女性和男性总体上受到的影响相似。但两性之间存在显著的基因水平差异(图1c),反映了骨髓恶性肿瘤中相关基因水平频率与患病率的性别特异性差异。同时,研究团队还证明了上述基因变化不仅与血液癌症有关,还与肺癌、前列腺癌和卵巢癌等其他肿瘤有关。
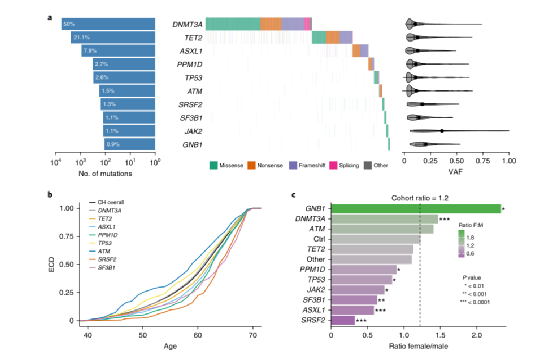
图1. CH在UKB中的表征。来源:Nature Genetics
为了确定CH与某些性状或疾病之间的关联,研究人员在200,453名参与者的队列中进行了以CH为结果的Logistic回归分析。研究揭示了CH与年龄、慢性炎性刺激和吸烟等因素相关。CH发生率随年龄增加而增加,每年约增加6.7%的风险,且普遍存在的高血压与CH状态有关。吸烟者与有吸烟史的个体发生CH的几率更高,这一关联适用于不同表型的CH,尤其是ASXL1突变的CH。研究人员通过对全血细胞计数和生化参数进行分析,确定了已知和未报道的CH关联因素,发现CH状态与低密度脂蛋白胆固醇水平相关,其中JAK2和剪接调节因子突变的CH最为显著。(图2a)
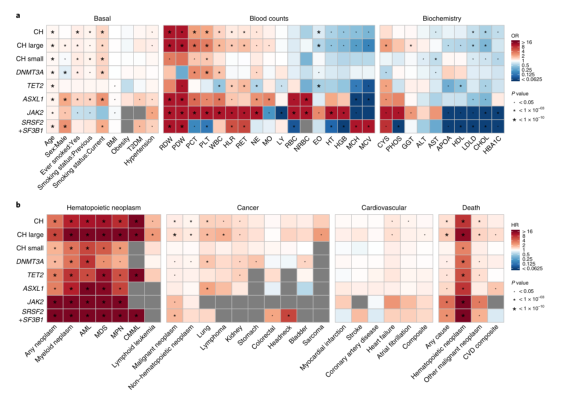
图2. CH与多种性状/疾病之间的关联。来源:Nature Genetics
研究人员还进行了一项关于突发疾病的全表型组关联研究(PheWAS),发现伴有CH的患者,髓系恶性肿瘤的发病率都较高,且其他血液和非血液性肿瘤的风险也显著增加,包括淋巴瘤、肺癌和肾癌。与以往将CH与缺血性心血管疾病(CVD)联系在一起的研究结果不同,该研究没有发现CH与缺血性CVD之间的显著关联,但发现CH与心力衰竭和心房颤动的关联。研究团队认为,CH加速了生物衰老过程,并影响了发生心房颤动的风险。(图2b)
研究人员基于200,453名参与者的遗传数据绘制了遗传性易感性图谱,将欧洲血统人群中的CH相关胚系突变数量从4个增加到14个,揭示了CH驱动基因与克隆大小的相关性的异质性,并通过功能注释揭示了可能的新CH易感基因,包括CD164、ATM和SETBP1。研究证明,在造血系统特有的表观遗传标记上,尤其是在造血干/祖细胞的开放染色质区域,CH的GWAS信号是丰富的。新基因位点与DNA损伤修复(PARP1、ATM、CHEK2)、造血干细胞迁移/归巢(CD164)和骨髓肿瘤发生(SETBP1)有关。其中部分关联具有CH亚型特异性,包括TCL1A和CD164的变体与DNMT3A-和TET2-突变的CH(两个最常见的CH亚型)呈负相关。
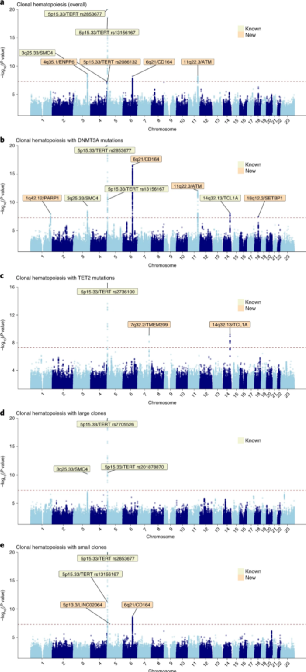
图3.曼哈顿图显示了常见的胚系遗传变异与五个CH性状之间的全基因组关联。来源:Nature Genetics
研究人员使用孟德尔随机化分析了CH与推定的风险因素和后果之间的潜在因果关系,结果表明,吸烟和较长的白细胞端粒长度是CH的因果风险因素,CH的遗传易感性增加了骨髓增生性肿瘤、非血液学恶性肿瘤、心房颤动和血液表观遗传学衰老的风险。分析显示,双样本孟德尔随机化的使用防止了由癌症治疗诱导的造血克隆选择压力引起的潜在反向因果关系。以上结果表明,CH的遗传易感性可能是其他癌症发展的生物标志物。
研究团队分析了来自200,453名英国生物库参与者的遗传数据,是同类研究中规模最大的项目之一。研究发现涉及异常血细胞克隆扩增的基因和机制,有助于帮助指导相关癌症的治疗进展,以避免或延缓克隆造血导致的健康后果。该研究结果充分阐明了CH遗传易感性,并提供了CH对人类健康和衰老影响的见解,为预防和早期发现包括白血病在内的癌症提供支持。
参考文献:
1.Caroline J. Watson et al. The evolutionary dynamics and fitness landscape of clonal hematopoiesis[J]. Science, 2020, 367(6485): 1449-1454.
2.Jaiswal Siddhartha and Ebert Benjamin L. Clonal hematopoiesis in human aging and disease[J]. Science (New York, N.Y.), 2019, 366(6465): eaan4673-eaan4673.
3.Genovese Giulio et al. Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence[J]. The New England journal of medicine, 2014, 371(26): 2477-87.
声明:本文来源测序中国,仅为交流学习。内容仅代表作者个人观点,望大家理性判断及应用。


















