
鉴定驱动侵袭性癌症形成的基因和通路一直是许多大规模基因组学工作的研究焦点,但大多数研究都集中在晚期肿瘤的整体分析上,在很大程度上忽略了癌前病变。结直肠癌(CRC)是研究沿恶性转化的表型状态连续性的理想系统,APC突变与息肉和CRC的发生有关,因此携带APC胚系突变的家族性腺瘤性息肉病(FAP)患者是研究肠息肉自然进展的合适人群。
为了绘制健康结肠向癌前腺瘤转变,进而恶性转变为CRC过程中发生的细胞组成和细胞状态变化,美国斯坦福大学医学院研究团队收集了48个息肉、27个正常组织和6个CRC的单细胞染色质可及性谱和单细胞转录组,每个样本包括1,000到10,000个细胞,样本来自于携带或不携带胚系APC突变的患者。近日,该研究成果以 “Single-cell analyses define a continuum of cell state and composition changes in the malignant transformation of polyps to colorectal cancer”为题发表在Nature Genetics 期刊上。研究发现,大部分肠息肉和CRC细胞为干细胞样表型,晚期息肉包含越来越多的干细胞样细胞、调节性T细胞和癌前相关的成纤维细胞亚型。此外,研究结果表明肠息肉细胞染色质可及性的变化与散发性CRC细胞的DNA甲基化变化呈强反相关,并确定了这些区域的子集,为检测癌前息肉提供了潜在的策略。
文章发表于Nature Genetics
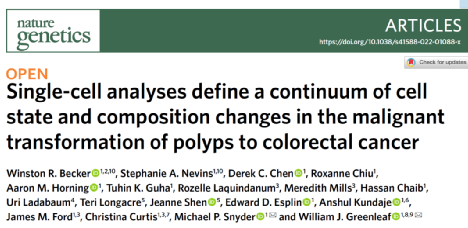
研究人员从8个FAP和7个非FAP供体收集了81个样本,利用scATAC-seq和snRNA-seq获得了201,884个细胞的单细胞转录组。通过对所有样本中的细胞进行亚聚类注释免疫细胞和基质细胞。免疫区室包括B细胞、T细胞、单核细胞、巨噬细胞、树突细胞和肥大细胞。为了分析仅在CRC中观察到T细胞衰竭,研究人员对CD3和PD1进行了CODEX成像,发现PD1在8个肠息肉中低表达或检测不到,在两个CRC样本中都检测到PD1表达。
在基质隔室内,研究人员鉴定了神经胶质细胞、脂肪细胞和多种类型内皮细胞和成纤维细胞。结果表明,肠息肉和CRC中存在不同表型的成纤维细胞,可能在癌前病变的肿瘤发生中发挥作用(图1)。
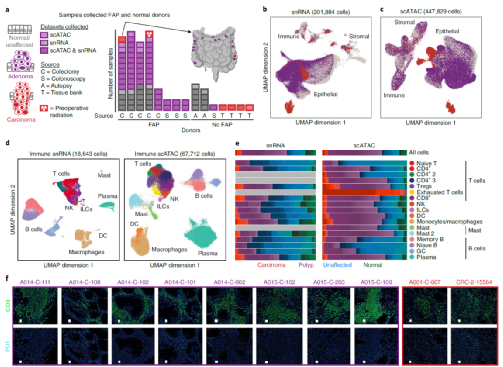
图1. CRC发展中的单细胞表达图谱和染色质可及性。来源:Nature Genetics
肿瘤相关成纤维细胞(CAF)可通过多种机制促进癌症的发展和进展,包括基质重塑与癌细胞的信号相互作用。已知CAF可促进CRC进展,研究人员探讨了成纤维细胞在癌前病变中的作用。结果表明,染色质变化促进了WNT2在CAF和preCAF中的表达。此外,通过检测的CAF和preCAF的表观遗传调控因子,发现CAF和preCAF存在相似性,表明preCAF可能与CAF具有相似功能。研究发现,CAF标记峰富含JUN/FOS和CEBP基序,preCAF标记峰富含JUN/FOS和FOX基序。在其基因表达与DNA基序的染色质可及性活性水平之间最相关的转录因子是RUNX1、RUNX2和CEBPB,RUNX1主要在CAF和preCAF中表达,与CAF中的广泛可及性有关(图2)。
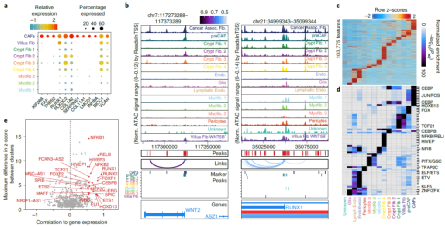
图2. preCAF和CAF的表观遗传调控因子。来源:Nature Genetics
研究人员检测了未受影响的肠息肉和CRC的上皮细胞,发现来自肠息肉和CRC的上皮细胞倾向于沿正常分化轨迹投射到更靠近干细胞和其他未成熟细胞的位置,而来自未受影响组织的细胞相对均匀地投射到整个上皮隔室中(图3)。通过对所有上皮细胞分类,发现肠息肉和CRC细胞富含干细胞样上皮细胞,成熟肠细胞则缺乏。
接下来,研究人员比较了肠息肉和CRC干细胞样细胞与正常干细胞的基因表达和染色质可及性,以确定癌前病变和癌变中的异常基因表达和调控程序。分析结果表明,肠息肉干细胞样细胞可形成潜在的恶性肿瘤连续体。干细胞和肠息肉干细胞样细胞之间的基因表达和染色质可及性差异遵循从早期息肉到晚期息肉到侵袭性CRC的进展规律。
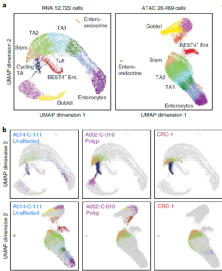
图3. 上皮细胞中观察到的干细胞特征。来源:Nature Genetics
研究人员选择了样本中差异表达的基因,将其聚类成十个k-means簇以分析恶性肿瘤连续体的基因表达变化。结果显示,十个k-means簇对应于肠息肉恶性转化不同阶段的差异表达基因组,且基因表达随恶性程度连续变化。进一步分析发现,TCF和LEF家族基序在所有簇中富集,息肉表现出TCF和LEF的活性增加,表明WNT信号传导沿着恶性连续谱增加,超过正常干细胞。簇4和5仅在CRC样本中表现出较大的可及性增加,并且HNF4A基序的富集最大(图4),表明HNF4A可能是肠息肉恶性转化的关键调节因子。
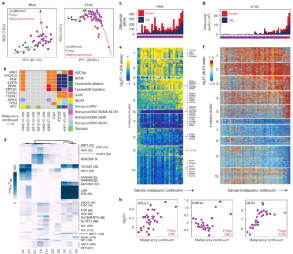
图4. 恶性转化的调控轨迹。来源:Nature Genetics
研究人员分析每种细胞类型对样本的贡献,发现样本中干细胞的比例在整个恶性转化过程中逐渐增加。类似地,随着肠息肉转化为癌,成熟肠细胞的数量逐渐减少。在基质隔室内,preCAF的比例逐渐增加,而CAF仅出现在CRC中。在免疫隔室中,Tregs在息肉和CRC中增加,耗尽T细胞仅出现在CRCs中。Tregs的逐渐增加可能是癌前息肉免疫逃避的一种机制。
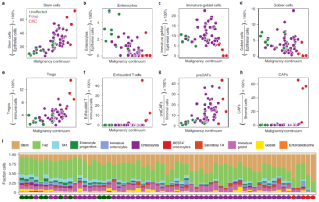
图5. 肠息肉恶性转化中细胞类型表征的动力学。来源:Nature Genetics
异常的DNA甲基化是CRC中肿瘤发生的主要机制,但甲基化变化的时间和程度驱动恶性转化之前和期间染色质可及性的变化尚不清楚。研究发现,与高甲基化探针重叠的峰内的聚集可及性较低,当它们与低甲基化探针重叠时,可及性更高。同时,研究人员还观察到79.4%显著更易接近和76.3%不易接近的峰与非差异探针重叠。
研究人员接下来绘制了恶性肿瘤连续体中与高甲基化和低甲基化探针重叠的差异峰数量(图6),发现在CRC甲基化区域中发生的染色质可及性变化沿着从正常到癌症的转变累积,在晚期息肉和CRC中观察到的数量最多。
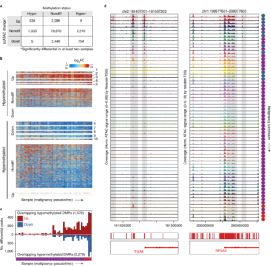
图6. CRC单细胞数据与甲基化数据的整合。来源:Nature Genetics
以往大多数分析恶性肿瘤中发生的遗传、表观遗传和转录组变化的工作都集中在晚期肿瘤而不是癌前病变上。该研究通过结直肠癌发生的单细胞图谱识别这种转化过程中发生的染色质可及性、基因表达和组织组成的关键变化填补了这一空白,为预防、诊断和治疗恶性肿瘤提供了大量潜在靶点。
Becker WR, Nevins SA, Chen DC, et al. Single-cell analyses define a continuum of cell state and composition changes in the malignant transformation of polyps to colorectal cancer [published online ahead of print, 2022 Jun 20]. Nat Genet. 2022;10.1038/s41588-022-01088-x. doi:10.1038/s41588-022-01088-x















