
从9年前开始,对于HER2阳性晚期乳腺癌,曲妥珠单抗+紫杉类治疗失败后,恩美曲妥珠单抗被指南推荐为二线治疗首选药物。直至2021年,德喜曲妥珠单抗与恩美曲妥珠单抗的头对头随机对照研究DESTINY-Breast03改写了指南。2022年3月,全球四大医学期刊之首、美国麻省医学会《新英格兰医学杂志》正式发表DESTINY-Breast03研究第一次中期分析报告全文,德喜曲妥珠单抗与恩美曲妥珠单抗相比,12个月进展或死亡风险减少72%、死亡风险减少45%,显著改变了HER2阳性晚期乳腺癌患者的命运。
DESTINY-Breast03 (NCT03529110): DS-8201a Versus T-DM1 for Human Epidermal Growth Factor Receptor 2 (HER2)-Positive, Unresectable and/or Metastatic Breast Cancer Previously Treated With Trastuzumab and Taxane
2022年12月7日,全球四大医学期刊之一英国《柳叶刀》正刊和美国第45届圣安东尼奥乳腺癌大会同时发表美国、巴西、中国、韩国、法国、澳大利亚、英国、日本、比利时、加拿大、意大利、西班牙等国学者联合发表的DESTINY-Breast03研究第二次中期分析报告全文,对德喜曲妥珠单抗与恩美曲妥珠单抗二线治疗HER2阳性晚期乳腺癌的有效性和安全性进行了再次比较。

该国际多中心非盲随机对照三期临床试验于2018年7月20日~2020年6月23日从北美、亚洲、欧洲、澳大利亚和南美169个研究中心入组年龄≥18岁、HER2阳性乳腺癌不可切除或转移、经过曲妥珠单抗和紫杉类治疗、美国东部肿瘤协作组体力状态评分0~1、根据实体瘤疗效评价标准1.1版至少有1个可测量病灶患者524例,按1∶1随机分入两组,其中261例接受德曲妥珠单抗5.4mg/kg,其余263例接受恩美曲妥珠单抗3.6mg/kg,均为每3周通过静脉输注给药。根据激素受体状态、既往帕妥珠单抗治疗和内脏疾病史对随机分组进行分层,并通过网络交互系统进行处理。患者和研究者对接受治疗非盲。主要终点为盲法独立集中复核的无进展生存。关键次要终点为总生存。本文为预设第二次总生存中期分析报告,对总生存、疗效和安全性结果进行更新。对全部意向治疗患者进行有效性分析,对全部实际治疗患者进行安全性分析。

结果,对于524例意向治疗患者,德曲妥珠单抗与恩美曲妥珠单抗相比:
中位随访:28.4比26.5个月(四分位:22.1~32.9、14.5~31.3)
中位无进展生存:28.8比6.8个月(95%置信区间:22.4~37.9、5.6~8.2)
进展或死亡风险:减少67%(风险比:0.33,95%置信区间:0.26~0.43,估算P<0.0001)
中位总生存:未达中位(95%置信区间:至少40.5个月、至少34.0个月)
总死亡风险:减少36%(风险比:0.64,95%置信区间:0.47~0.87,P=0.0037)
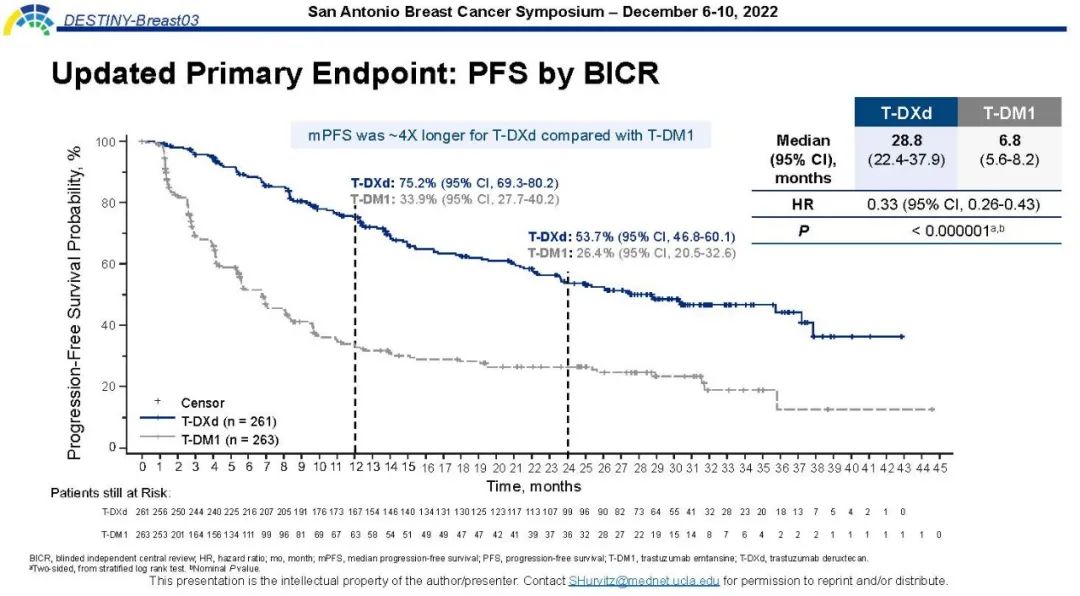
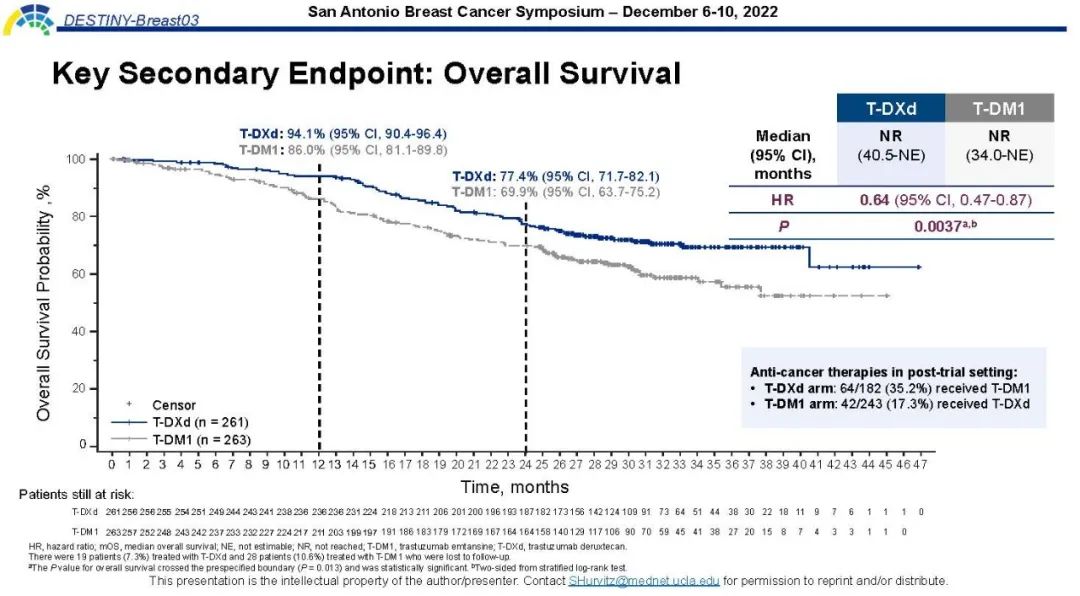
对于518例实际治疗患者,德曲妥珠单抗与恩美曲妥珠单抗相比:
≥3级治疗相关不良事件发生率:56%比52%
药物相关间质性肺病或肺炎发生率:15%比3%
两组均未发生4或5级事件。
因此,该研究结果表明,对于HER2阳性晚期乳腺癌,德曲妥珠单抗与恩美曲妥珠单抗相比,患者总生存显著改善,中位无进展生存延长超过四倍,进展或死亡风险减少超过三分之二,再次确认德曲妥珠单抗二线治疗标准地位。随着治疗持续时间延长,德曲妥珠单抗可控的安全性得到证实。
声明:本文来源SIBCS,仅为交流学习。内容仅代表作者个人观点,望大家理性判断及应用。













